-
2015年8月12日晚11时许,天津市塘沽开发区一带发生爆炸事故,现场火光冲天。据多位市民反映,事发时十公里范围内均有震感,抬头可见蘑菇云,安全问题再次敲响了警钟。下列关于安全问题的说法,不正确的是( )
A.危险化学品包括:爆炸品、易燃物质、自燃自热物质、氧化性气体、加压气体等
B.金属钠着火不能用水灭火,应使用干砂灭火
C.处置实验过程产生的剧毒药品废液,稀释后用大量水冲净
D.简单辨认有味的化学药品时,将瓶口远离鼻子,用手在瓶口上方扇动,稍闻其味即可
难度: 简单查看答案及解析
-
下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应生成酸式盐 ②弱酸与盐溶液反应可以生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应
⑥两种氧化物反应的产物有气体
A.6个 B.5个 C.4个 D.3个
难度: 中等查看答案及解析
-
分子式为C5H10O2的酸和分子式为C5H12O的醇在酸性条件下形成的酯共有
A.16种 B. 20种 C. 32种 D. 40种
难度: 困难查看答案及解析
-
下列分子或离子在指定的分散系中能大量共存的一组是
A.碱性溶液中:ClO-、Cl-、K+、Na+
B.常温常压下气体:O2、N2、Cl2、NH3
C.含有AlO2-的溶液:NO3-、HCO3-、Na+、K+
D.氢氧化铁胶体:H+、K+、S2-、Br-
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA
B.常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA
C.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
D.标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+3、+5、-3
-2
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,W单质可以将Z从其氢化物中置换出来
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.常温下,Z单质与W的常见单质直接生成ZW2
难度: 中等查看答案及解析
-
今有120 mL, 0.20 mol/L Na2CO3的溶液和某浓度的200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.1.5 mol/L B.2.0mol/L C.0.18 mol/L D.0.24mol/L
难度: 中等查看答案及解析
-
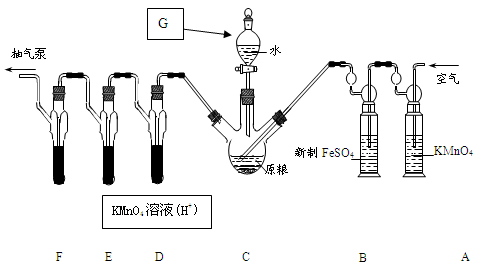
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
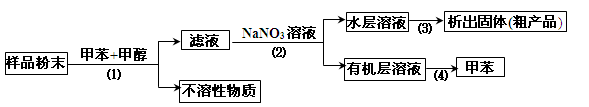
下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
难度: 简单查看答案及解析
-
某有机物X的结构简式如下图所示,则下列有关说法中正确的是( )
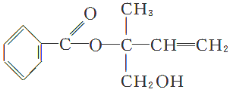
A.X的分子式为C12H16O3
B.X在一定条件下能发生加成、加聚、取代、消去等反应
C.在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成
D.可用酸性高锰酸钾溶液区分苯和X
难度: 中等查看答案及解析
-
已知2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ•mol-1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ΔH= -226 kJ•mol-1
下列表述正确的是
A.1molCO燃烧时放出的热量为283kJ•mol-1
B.Na2O2(s)+CO(g)=Na2CO3(s)ΔH=-509kJ•mol-1
C.Na2O2(s)与CO2(g)反应放出226kJ热量时电子转移数为2NA
D.Na2O2和Na2CO3中阴阳离子个数比不同
难度: 中等查看答案及解析
-
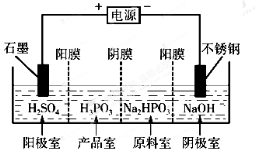
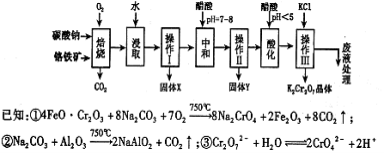
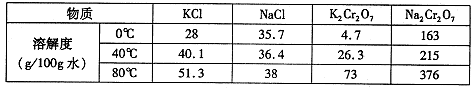
铵明矾
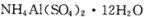 是分析化学常用基准试剂,其制备过程如下。下列分
是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是
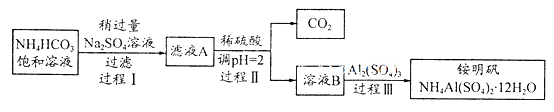
A.过程I反应:
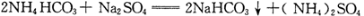
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程II则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀
生成→白色沉淀消失
难度: 困难查看答案及解析
-
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
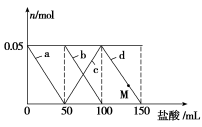
A.a曲线表示的离子方程式为:AlO2-+H++H2O===Al(OH)3↓
B.b和c曲线表示的离子反应是相同的
C.M点时,溶液中沉淀的质量为3.9 g
D.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
难度: 困难查看答案及解析
-
根据表中信息判断,下列选项不正确的是
序号
反应物
产物
①
KMnO4 、H2O2 、H2SO4
K2SO4 、MnSO4
②
Cl2 、FeBr2
FeCl3 、FeBr3
③
MnO4- .
Cl2 、Mn2+
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比小于或等于1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
难度: 中等查看答案及解析
-
已知A、B为单质,C为化合物。则下列说法正确的是( )
A+B
C
C溶液
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.③④ C.①③ D.②④
难度: 困难查看答案及解析
-
下列有关实验操作、现象、解释和结论都正确的是( )
操 作
现 象
解释、结论
A
把过量的Fe粉中加入硝酸中充分反应,滴入KSCN溶液
溶液呈红色
稀硝酸将Fe氧化为Fe3+
B
向饱和Na2CO3溶液中通入足量CO2
溶液变浑浊
析出了Na2CO3晶体
C
Al箔插入稀硝酸中
无现象
Al在硝酸中钝化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
难度: 中等查看答案及解析
-
m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是
A.沉淀中OH-的质量为(n-m)g
B.恰好溶解后溶液中的NO3-的物质的量为aVmol
C.反应过程中转移的电子的物质的量为
mol
D.与合金反应的硝酸的物质的量为
mol
难度: 极难查看答案及解析