-
化学已渗透到人类生活的各个方面,下列说法不正确的是
A. 现代工业中的芳香烃主要来源于煤的干馏和石油的催化重整
B. 新买的衣服先用水洗,可除去衣服上残留的有防皱作用的甲醛整理剂
C. Na2S具有较强的还原性,因此可用作Cu2+与Hg2+的沉淀剂
D. 火药是由硫磺、木炭、硝酸钾按照一定比例混合制成的
难度: 中等查看答案及解析
-
下列离子在指定溶液中能共存的是
A. 中性溶液中:Na+、Fe3+、Cl-、SO42-
B. 使甲基橙显红色的溶液:Ca2+、NH4+、A1O2-、NO3-
C. 与Al反应放出H2的溶液中:SO42-、NO3-、 SiO32-、Na+
D. 0.1mol/L的AlCl3溶液:ClO-、HCO3-、K+、I-
难度: 简单查看答案及解析
-
下列实验能达到实验目的的是
选项
实验目的
实验方案
A
检验食盐中是否添加KIO3
取食盐试样,溶于KI 溶液,加入淀粉溶液,观察溶液是否变蓝
B
验证CO2具有氧化性
将金属钠在燃烧匙中点燃并迅速伸入集满CO2 的集气瓶,观察集气瓶中产生大量白烟并有黑色颗粒
C
证明HCO3-结合H的能力比CO32-强的
室温下,用PH 试纸测得: 0.1mol/L Na2CO3 溶液的pH 约为12,0.1mol/L NaHCO3 溶液的pH 约为8
D
溶液中含Fe3+
向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA 为阿伏加德罗常数。下列说祛正确的是
A. pH 为1的H3BO3 溶液中,含有0.1 NA 个H+
B. 0.1mol PCl3与0.1mol Cl2充分反应制备PCl5,转移的电子数为0.2 NA
C. 31g红磷(P)与白磷(P4)的混合物中P 原子数为NA
D. 足量的铁与lmol Cl2 反应生成FeCl2,转移电子数为2 NA
难度: 中等查看答案及解析
-
四种短周期主族元素X、Y、Z、W的原子序数依次增大,Z 的原子半径是短周期主族元素中最大的,Y 与W同主族且X、Y和W 最外层电子数之和为17,Y 的一种单质具有很强的氧化性,可用于杀茵消毒。X的一种氢化物可用作火箭推进剂。下列说法不正确的是
A. Y的简单氢化物的热稳定性比X强
B. Y、Z、W 三种元素形成的一种能与盐酸反应产生淡黄色沉淀和刺激性气味气体的盐为Na2S2O3
C. Y、Z的简单离子具有相同的电子层结构
D. Y 与Z形成的化合物为离子化合物,其中只含离子键,不含共价键
难度: 中等查看答案及解析
-
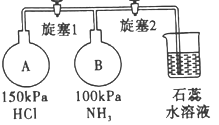
某化学小组在一定温度下将Cl2 缓缓通入适量的NaOH 溶液中,得到产物为NaCl、NaClO、NaClO3,且c(Cl-):c(ClO3-)的值与温度有关。当n(NaOH)=amol 时,下列说法错误的是
A. 工业上在特定条件下电解饱和食盐水制得NaClO3,原理为NaCl+3H2O
NaClO3+3H2 ↑
B. 参加反应的Cl2与NaOH 的物质的量之比为1:2
C. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
D. 改变温度,反应中转移电子的物质的量n 的范围:a/2 mol≤n≤5a/6mol
难度: 困难查看答案及解析
-
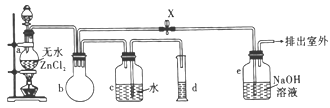
已知:Fe5O7可以看作Fe2O3和Fe3O4的混合物,现有Fe、Fe5O7混合物共0.lmol,加盐酸后固体全部溶解,共收集到0.0lmolH2,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
A. 0.02mol B. 0.04mol C. 0.09mol D. 0.07mol
难度: 困难查看答案及解析

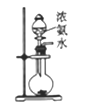
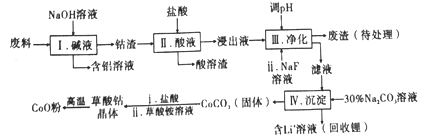
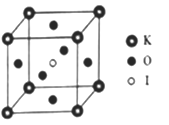
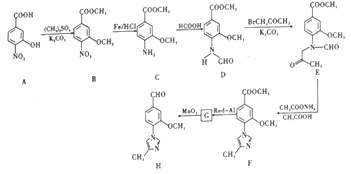
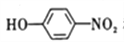 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备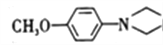 的合成路线流程图_________________________________(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_________________________________(无机试剂任用,合成路线流程图示例见本题题干)。