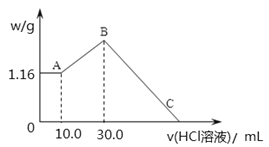
-
要使氯化铝溶液中的Al3+完全转化为Al(OH)3沉淀,应选用的最佳试剂是
A. NaOH溶液 B. 稀盐酸 C. 氨水 D. AgNO3溶液
难度: 中等查看答案及解析
-
“保护环境”是我国的基本国策。下列做法不应该提倡的是
A. 对生活废弃物进行分类处置 B. 过度开发资源促进经济发展
C. 煤炭燃烧时安装“固硫”装置 D. 宣传“低碳”出行
难度: 简单查看答案及解析
-
下列化学用语的表达正确的是
A. 碳酸钠的电离方程式:Na2CO3=Na2++CO32-
B. S2-的结构示意图:
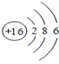
C. 中子数为20的氯原子:
D. 硫酸亚铁的化学式:FeSO4
难度: 简单查看答案及解析
-
分离沸点相差较大的液体混合物,可用蒸馏法,下列不是蒸馏实验必须的仪器或材料的是
A. 温度计 B. 冷凝管 C. 沸石(碎瓷片) D. 漏斗
难度: 简单查看答案及解析
-
需在容量瓶上标出的是下列中的:①温度 ②浓度 ③容量 ④压强 ⑤刻度线
A. ①③⑤ B. ②③⑤ C. ①②④ D. ②④⑤
难度: 简单查看答案及解析
-
相同状况下,等质量的铝分别与足量稀盐酸和氢氧化钠溶液反应放出氢气的体积之比为
A. 3:1 B. 2:1 C. 1:1 D. 1:3
难度: 简单查看答案及解析
-
下列各组离子在溶液中能大量共存的是
A. Al3+、K+、OH-、NO3- B. Ba2+、Na+、SO42-、OH-
C. H+、K+、CO32-、Cl- D. K+、Na+、SO42-、 Cl-
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 71 g Cl2含有的氯原子数目为NA
B. 标准状况下,2.24 L水所含的分子数为0.1 NA
C. 1 mol•L-1A1Cl3溶液中含有的Cl﹣数目为1NA
D. 2.4 g金属镁变成镁离子时失去的电子数目为0.2 NA
难度: 中等查看答案及解析
-
某单质在二氧化碳中可以燃烧生成一种黑色物质和另一种白色物质,该单质可能是
A. S B. Si C. Mg D. Fe
难度: 简单查看答案及解析
-
中国最新战机歼-31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应如下:TiCl4+2Mg
Ti+2MgCl2。下列有关该反应的说法正确的是

A. TiCl4是还原剂 B. Mg被氧化
C. TiCl4发生氧化反应 D. Mg得到电子
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A. 碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O
B. AgNO3溶液与NaCl溶液的反应:Ag++ Cl-= AgCl↓
C. 稀醋酸与氢氧化钠溶液的反应:H+ + OH-= H2O
D. Fe跟稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
难度: 中等查看答案及解析
-
下列各个反应,不能用于工业生产的是
A. 钠与氯气反应制食盐 B. 电解熔融氧化铝制金属铝
C. 煅烧黄铁矿(FeS2)制SO2 D. 氯气与石灰乳反应制漂白粉
难度: 中等查看答案及解析
-
下列图示装置的实验中,操作正确的是
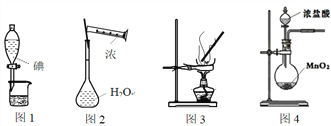
A. 图1分离碘酒中的碘和酒精 B. 图2用浓硫酸配制稀硫酸
C. 图3食盐水制得食盐晶体 D. 图4用于实验室制备氯气
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 自来水厂可用明矾作净水剂
B. 二氧化硅是酸性氧化物,所以二氧化硅可以与水反应生成硅酸
C. 丁达尔效应是区分胶体与溶液的一种常用方法
D. 浓硫酸具有脱水性,可使蔗糖脱水炭化
难度: 简单查看答案及解析
-
下列实验现象与结论均正确的是
实验操作
实验现象
实验结论
A
向未知液中滴加氯水,再滴加KSCN溶液
溶液呈红色
未知液中一定含有Fe2+
B
向无色溶液中滴加氯水,再加CCl4振荡,静置
溶液分层,下层呈紫红色
无色溶液中含有I-
C
某少量气体通入澄清石灰水
澄清石灰水变浑浊
该气体一定是CO2
D
向酸性KMnO4溶液中通入SO2气体。
酸性KMnO4溶液褪色
SO2具有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知在碱性溶液中可发生如下反应:2R(OH)3 + 3C1O-+ 4OH- = 2RO4n-+3Cl- +5H2O。关于该反应的说法正确的是( )
A. RO4n-中 R 的化合价是+6
B. ClO—是还原剂
C. 由上述离子方程式可知,该反应是由氨水提供的碱性环境
D. 反应过程中生成1mol RO4n-,转移6mol e-。
难度: 中等查看答案及解析