-
下列物质中各含有少量杂质,能用饱和Na2CO3溶液并借助于分液漏斗除去杂质的是
A. 苯中含有少量甲苯 B. 乙醇中含少量乙酸
C. 乙酸乙酯中含有少量乙酸 D. 溴苯中含有少量苯
难度: 中等查看答案及解析
-
25℃某浓度的盐酸、氯化铵溶液中水电离出的氢离子浓度分别为:1.0×10-amol·L-1、
1.0×10-bmol·L-1,则这两种溶液的pH之和为
A. 14-a+b B. 14+a+b C. 14-a-b D. 14+a-b
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 乙酸的结构式:CH3COOH
C. 2﹣丁烯的键线式:
D. 乙醇分子的比例模型:

难度: 中等查看答案及解析
-
下列事实对应的离子方程式或电极反应式书写正确的是( )
A. 用石墨作电极电解CuSO4溶液2Cu2++2H2O
2Cu+O2↑+4H+
B. 碳酸钠溶液显碱性:CO32-+2H2O
H2CO3+2OH-
C. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D. 在强碱溶液中Fe(OH)3与NaClO反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
一定条件下,碳钢腐蚀与溶液的pH的关系如下:
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2-
下列说法不正确的是( )
A. 在pH<4溶液中,碳钢主要发生析氢腐蚀
B. 在pH>6溶液中,碳钢主要发生吸氧腐蚀
C. 在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D. 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
难度: 困难查看答案及解析
-
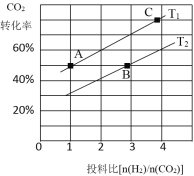
一定条件下,在恒容密闭容基中,能表示反应X(气)+2Y(气)
2Z(气)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2 ∶2②X、Y、Z的浓度不再发生变化③容器中的压强不再发生变化④单位时间内生成nmolZ,同时消耗nmol Y
A. ①② B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
处于平衡状态的反应2 H2 S(g)
2H2(g)+S2(g)
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
难度: 中等查看答案及解析
-
关于如图中四个图像的说法正确的是( )

注:图中,E表示能量,p表示压强,t表示时间,V表示体积。
A. ①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热ΔH=183kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g)
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D. ④表示10mL0.1mol/LNa2CO3和NaHCO3两种溶液中,分别滴加0.1mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
难度: 困难查看答案及解析
-
要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物
PbSO4
PbCO3
PbS
溶解度/g
1.03×10-4
1.81×10-7
1.84×10-14
由上述数据可知,选用沉淀剂最好为( )
A. 硫化物 B. 硫酸盐
C. 碳酸盐 D. 以上沉淀剂均可
难度: 中等查看答案及解析
-
已知某温度下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. 溶液一直显中性
C. c(CH3COOH)与c(CH3COO‾)之和始终保持不变
D. 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO‾)
难度: 中等查看答案及解析
-
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO
下列说法正确的是( )
A. NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B. 充电过程中OH-从阳极向阴极迁移
C. 充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D. NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
难度: 中等查看答案及解析
-
标准状况下,3.36L某气态烃A在足量O2中完全燃烧。若将产物通入足量澄清石灰水中,得到的白色沉淀质量30.0g;若用足量的碱石灰吸收燃烧产物,增重18.6g。则该烃的分子式为( )
A. C2H6 B. C3H8 C. C3H6 D. C2H4
难度: 中等查看答案及解析
-
电化学在日常生活中用途广泛,图①是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理。下列说法正确的是( )

A. 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②的电解池中,有0.084 g阳极材料参与反应,阴极会有336mL的气体产生(标况)
C. 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D. 若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀
难度: 困难查看答案及解析
-
关于有机物
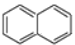 和
和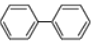 的说法正确的是
的说法正确的是A. 二者互为同系物 B.
 的一氯代物有 3 种
的一氯代物有 3 种C.
 的二氯代物有 12 种 D. 二者均能发生还原反应、加聚反应
的二氯代物有 12 种 D. 二者均能发生还原反应、加聚反应难度: 中等查看答案及解析
-
下列装置或操作与说法正确的是( )
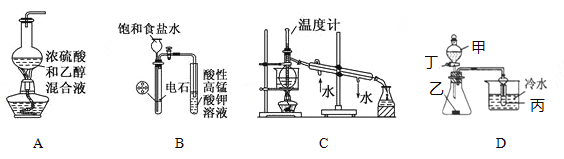
A. 实验室制乙烯
B. 实验室制乙炔并验证乙炔能发生氧化反应
C. 实验室中分馏石油
D. 若甲为醋酸,乙为贝壳(粉状),丙为苯酚钠溶液,则该装置不可以验证醋酸、碳酸、苯酚酸性的强弱
难度: 中等查看答案及解析