-
下列说法正确的是
A.反应热就是反应中放出的能量
B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C.由C(s,石墨)= C(s,金刚石),ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
难度: 中等查看答案及解析
-
某反应2AB(g)
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的正反应的ΔH、ΔS应为
A.ΔH<0,ΔS>0 B.ΔH<0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH>0,ΔS<0
难度: 中等查看答案及解析
-
把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是
A.10℃20mL 3mol/L的X溶液 B.20℃30mL 2mol/L的X溶液
C.20℃10mL 4mol/L的X溶液 D.10℃10mL 2mol/L的X溶液
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 中等查看答案及解析
-
对于反应2NO2(g)
N2O4(g)达到平衡后,在温度不变时欲使c(NO2)/c(N2O4)比值增大,可以采取
A.体积不变,增加NO2的量 B.体积不变,增加N2O4的量
C.使体积扩大到原来的2倍 D.使体积不变充入N2
难度: 中等查看答案及解析
-
已知下列热化学方程式:
① Fe2O3(s)+ 3CO(g)= 2Fe(s)+ 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s)+ CO(g)= 2Fe3O4(s)+ CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是
A.Fe3O4 + 4CO = 3Fe + 4CO2 △H= -14kJ·mol-1
B.Fe3O4(s)+ 4CO(g)= 3Fe(s)+ 4CO2(g) △H= -22kJ·mol-1
C.Fe3O4(s)+ 4CO(g)= 3Fe(s)+ 4CO2(g) △H= +14kJ·mol-1
D.Fe3O4(s)+ 4CO(g)= 3Fe(s)+ 4CO2(g) △H= -14kJ·mol-1
难度: 中等查看答案及解析
-
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
①Ag2SO4(s)
Ag2O(s)+SO3(g) ②2SO3(g)
2SO2(g)+O2(g)经10分钟反应达到平衡,此时c(SO3)=0.4 mol/L,c(O2)=0.05 mol/L,下列叙述不正确的是
A.SO3的分解率为20% B.10分钟内ν(SO2)=0.01mol/(L·min)
C.容器内气体的密度为40g/L D.此温度下反应①的平衡常数为4
难度: 中等查看答案及解析
-
在固定容积的密闭容器中,可逆反应2X(?)+Y(g)
Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是
A.正反应为放热反应,X可能是气态、液态或固态
B.正反应为放热反应,X一定为气态
C.若X为非气态,则正反应为吸热反应
D.若加入少量的Z,该平衡向左移动
难度: 中等查看答案及解析
-
一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)
3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
A.4molA+2molB
B.3molC+2molD
C.1molB+3molC+1molD
D.2molA+1molB+3molC+1molD
难度: 中等查看答案及解析
-
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)
nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:

下列说法正确的是
A.m>n
B.温度不变,压强增大,Y的质量分数减少
C.Q<0
D.体积不变,温度升高,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
已知反应①:CO(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的△H>0
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
难度: 中等查看答案及解析
-
可逆反应N2(g)+3H2(g)
2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2。下列叙述不正确的是
A.达到平衡时,两容器中反应物的转化率不同
B.达到平衡时,甲中NH3的体积分数与乙相等
C.达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动
D.乙中的热化学反应方程式为2NH3(g)
N2(g)+3H2(g);△H=+Q2KJ/mol
难度: 困难查看答案及解析
-
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
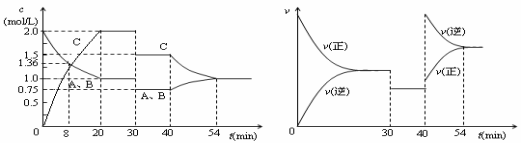
A.第8min时 A的反应速率为0.08mol·L-1·min-1
B.在0-54分钟的反应过程中该可逆反应的平衡常数始终为4
C.30min时改变的条件是降低温度,40min时改变的条件是升高温度
D.反应方程式中的x=1,且正反应为放热反应
难度: 困难查看答案及解析
-
右图表示298K时N2与H2反应过程中的能量变化。根据右图叙述正确的是
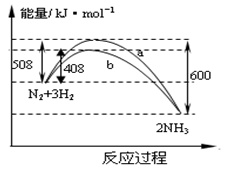
A.该反应的热化学方程式为
N2(g)+
H2(g)
NH3(g),△H=-92kJ·mol-1
B.不用催化剂,生成 1molNH3放出的热量为46 KJ
C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
难度: 中等查看答案及解析