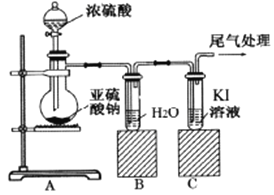
-
下列关于煤、石油、天然气的说法正确的是
A. 丙烯等石油产品可用于生产塑料
B. 水煤气是通过煤的干馏得到的气体燃料
C. 天然气只能用做燃料
D. 石油裂化得到的汽油是一种纯净物
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
B. 1molNa被完全氧化生成Na2O2,失去NA个电子
C. 标准状况下,11.2LC6H6中含有的分子数目为0.5NA
D. 0.1mol/LK2S溶液中含有的K+数为0.2NA
难度: 中等查看答案及解析
-
下列与有机物的结构、性质有关的叙述不正确的是
A. 乙醇、乙烯均能使酸性KMnO4溶液褪色
B. 光照下甲烷和Cl2的反应、在FeBr3催化下苯和Br2的反应,均属于同一类型的反应
C. 甲醇、醋酸均能与Na 反应放出H2,二者所含官能团相同
D. 葡萄糖与果糖互为同分异构体,其结构中均含有5个羟基
难度: 中等查看答案及解析
-
列有关实验操作,现象和解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
向某溶液中滴加双氧水后再加入KSCN 溶液
溶液呈红色
溶液中一定含有Fe2+
B
向饱和Na2CO3 溶液中通入足量CO2
溶液变浑浊
析出了NaHCO3晶体
C
两块相同的铝箔,其中一块用砂纸仔细打磨过,将两块铝箔分别在酒精灯上加热
打磨过的铝箔先熔化 并滴落下来
金属铝的熔点较低,打磨过的铝箔更易熔化
D
加热盛有NaCl和NH4Cl固体的试管
试管底部固体减少,试管口有晶体凝结
可以用升华法分离NaCl和 NH4Cl 固体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如右图,其中Y元素原子电子层數等于最外层电子数。下列说法不正确的是
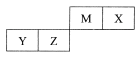
A. Z位于元素周期表中第三周期、第IVA族
B. Y 的最高价氧化物不能和X 的简单氢化物反应
C. M的非金属性比Z的弱
D. 原子半径比较: X<M
难度: 中等查看答案及解析
-
如下图所示装置图,下列叙述不正确的是

A. X 与滤纸接触处的铜丝发生反应Cu-2e-=Cu2+
B. 碳棒表面逐渐生成红色物质
C. 若隔膜左侧溶液中始终只有一种溶质,则A离子不能是Cu2+
D. 若滤纸与Y接触处变红,则B溶液可以是AgNO3溶液
难度: 中等查看答案及解析
-
25℃时,有c(HA)+c(A-)=0.1mol/L 的一组HA、KA 混合溶液,溶液中c(HA)、c(A-)与pH的关系如下图所示。下列叙述不正确的是

A. pH= 5.75 的溶液中: c(K+)>c(A- )>c(HA)>q(H+)>c(OH- )
B. 欲得W 点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1mol/L 且c(KA)
C. pH=3.75的溶液中:c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L
D. 若A-的水解常数为Kb 则lgKb=-9.25
难度: 困难查看答案及解析
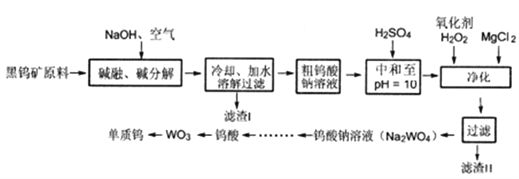
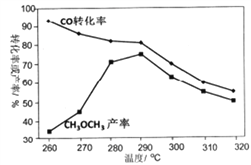
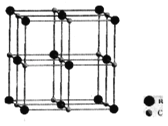
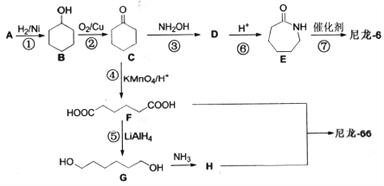
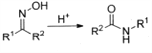
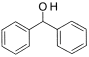 设计路线合成
设计路线合成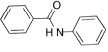 (其余小分子原料自选)。
(其余小分子原料自选)。