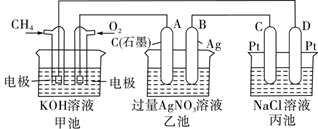
-
电池在生产、生活中应用越来越广泛。下列说法错误的是
A.化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,不能充电
B.铅蓄电池应用广泛,主要优点是单位重量的电极材料释放的电能大
C.燃料电池具有能量利用率高、可连续使用和污染轻等优点
D.锂电池是一种高能电池,体积小、重量轻,单位质量能量比高
难度: 中等查看答案及解析
-
下列说法正确的是
A.物质发生化学变化不一定伴随着能量变化
B.硫酸钡、醋酸铵、氨水都是弱电解质
C.用Na2S溶液与AlCl3溶液混合制取Al2S3
D.在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行
难度: 中等查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中导电粒子的数目增加,导电性增强
B.醋酸的电离程度增大,[H+]减小
C.再加入10mL pH=11 NaOH溶液,混合液pH=7
D.溶液中由水电离出的[H+]=1×10-11 mol/L
难度: 中等查看答案及解析
-
500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g)
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
A.平衡向正反应方向移动
B.平衡常数K增大
C.NO2的转化率变小
D.容器内气体颜色先变深后变浅,最后比原来还要浅
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.用装置①进行电镀,镀件接在b极上
C.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
D.装置③中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
下列说法正确的是
A.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H相同
B.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
C.已知:①2H2(g) +O2(g) =2H2O(g) △H=-a kJ·mol-1,②2H2(g)+O2 (g)= 2H2O(1) △H=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2 (g)=CO2(g) △H=- 393.5kJ·mol-1,②C(s,金刚石)+O2(g)=CO2 (g) △H=- 395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) △H= -1.5 kJ·mol-1
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能大量共存的是
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
B.[H+]=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C.[OH-]/ [H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32-
D.由水电离的[H+]=1.0×10-13 mol·L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3-
难度: 中等查看答案及解析
-
某温度时,AgCl(s)
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
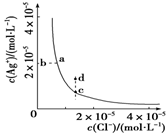
下列说法正确的是
A.加入AgNO3,可以使溶液由c点变到d点
B.加入少量水,平衡右移,Cl-浓度减小
C.d点没有AgCl沉淀生成
D.c点对应的Ksp等于a点对应的Ksp
难度: 中等查看答案及解析
-
下列离子方程式中,书写正确的是
A.弱酸酸式盐NaHB在水溶液中水【解析】
HB–+H2OH3O++B2–
B.电解饱和食盐水:C1-+2H2O
H2↑+Cl2↑+OH-
C.氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH-
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
难度: 中等查看答案及解析
-
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-=Zn(OH)2 +2e-; Ag2O +H2O +2e- =2Ag +2OH-。下列说法错误的是
A.溶液中OH-向正极移动 B.锌发生氧化反应
C.氧化银是正极 D.在电池放电过程中,电解质溶液的碱性增强
难度: 中等查看答案及解析
-
可逆反应2A(g)+B(g)
2C(g),根据下表中的数据判断下列图像错误的是

难度: 中等查看答案及解析
-
已知水的电离方程式:H2O
H+ + OH-。下列叙述中,正确的是
A.升高温度,KW增大,pH不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,KW不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
难度: 中等查看答案及解析
-
下列表述正确的是
A.0.1mol·L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3]
B.0.1mol·L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-]
C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH) <c (Na2CO3) <c(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO-]>[Na+]>[OH-]=[H+]
难度: 中等查看答案及解析
-
把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(g)+ B(g)
2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是
A.B的转化率为25%
B.A的平均反应速率为0.15mol·(L·min)-1
C.恒温下达到平衡的标志是C和D的生成速率相等
D.降低温度,逆反应速率变小,正反应速率增大,平衡正向移动
难度: 中等查看答案及解析
-
下列有关实验的说法正确的是。
A.在测定中和反应的反应热实验中,至少要读两次温度
B.可用pH试纸测定新制氯水的pH
C.中和滴定实验中,洗净后的锥形瓶不需要干燥
D.向CH3COONa溶液中滴入石蕊试液,溶液变蓝
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)〈Ksp(CuS)
难度: 中等查看答案及解析