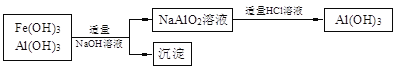-
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与l00mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g、FeCl20.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. l00mL的盐酸中HC1物质的量浓度为7.5mol/L
B. 生成的H2S气体在标准状况下的体积为2.24L
C. 该磁黄铁矿中FexS的x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1
难度: 困难查看答案及解析
-
化学与生产生活联系紧密,下列有关说法正确的是
A. 只用淀粉溶液即可检验食盐是否为加碘盐
B. 氢氟酸刻蚀水晶饰品体现其酸性
C. 水垢中的CaSO4,可先转化为CaCO3,再用酸除去
D. 煤经过气化和液化等物理变化可转为清洁能源
难度: 中等查看答案及解析
-
下列与化学有关的文献,理解错误的是
A. 《咏石灰》(明·于谦)中“…烈火焚烧若等闲…要留清白在人间”其中“清白”是指氢氧化钙
B. 《咏煤炭》(明·于谦)中“凿开混沌得乌金…不辞辛苦出山林”其中“乌金”的主要成分是煤炭
C. 《天工开物》中记载:“以消石、硫磺为主。草木灰为辅。…魂散惊而魄齑粉”文中提到的是火药
D. 《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质…”文中的“裘”主要成分是蛋白质
难度: 简单查看答案及解析
-
1mol化学式为C4H8O3的物质分别与足量的NaHCO3且和Na反应产生气体的物质的量相等,满足条件的同分异构体数目为(不考虑空间异构)
A. 4种 B. 5种 C. 6种 D. 7种
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 80℃时,1L pH=l的硫酸溶液中,含有的OH-数目为10-13NA
B. 向含有FeI2的溶液中通人适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA
C. l00g质量分数为46%的乙醇水溶液中氧原子数为4NA
D. 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子
难度: 中等查看答案及解析
-
下列解释实验过程或事实的反应方程式不正确的是
A. 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH
Na2SiO3+H2O
B. 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+ H2O2+2H+= I2+O2↑+2H2O
C. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g)
Fe3O4+4H2
D. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+ Cl-+ 2H+= Cl2↑+H2O
难度: 中等查看答案及解析
-
某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:下列有关实验的叙述中,不正确的是
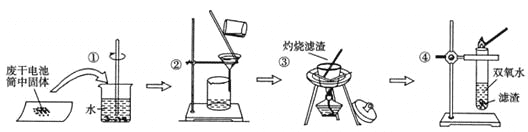
A. 操作①中玻璃棒的作用是加快固体溶解速度
B. 操作②的操作名称是过滤
C. 操作③中盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中杂质
难度: 中等查看答案及解析
-
已知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是
A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
D. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.
的溶液中:Na+、K+、SiO32—、SO32-
B. pH=1的溶液中:K+、Al3+、SO42-、F—
C. 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl-
D. 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2-
难度: 中等查看答案及解析
-
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是

①1mol该有机物可消耗3mol H2; ②不能发生银镜反应; ③分子式为C12H20O2; ④它的同分异构体中可能有酚类; ⑤1 mol该有机物水解时只能消耗1mol NaOH
A. ②③④ B. ①④⑤ C. ①②③ D. ②③⑤
难度: 困难查看答案及解析
-
优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为2Li+P2VP•nI2= P2VP•(n-1)I2+2LiI,则下列说法正确的是
A. 正极的反应为P2VP•nI2+2e-= P2VP•(n-1)I2+2I-
B. 电池工作时,碘离子移向P2VP极
C. 聚2-乙烯吡啶的复合物与有机物性质相似,因此聚2-乙烯吡啶的复合物不会导电
D. 该电池所产生的电压低,使用寿命比较短
难度: 中等查看答案及解析
-
由下列实验操作和现象得出的结论正确的是
选项
实验操作
实验现象
结论
A
将氯气、SO2气体分别通入品红溶液
溶液均退色
氯气、SO2均有漂白性且漂白原理相同
B
某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸
试纸变蓝
NH3是碱
C
硝酸银溶液中加少量NaCl溶液,再加KI溶液
先出现白色沉淀,后出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
D
FeCl3溶液中通入足量SO2气体,然后滴入KSCN溶液
溶液不变红
还原性SO2>Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
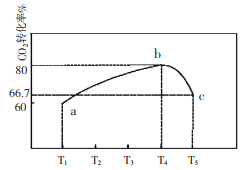
一定条件下,CO2(g)+3H2(g)
H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是
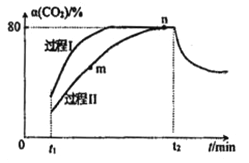
A. m点:v(正)>v(逆)
B. 活化能:过程Ⅱ>过程I
C. n点时该反应的平衡常数K=50
D. 过程I,t2时刻改变的反应条件可能是升高温度
难度: 困难查看答案及解析
-
某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,
现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.435 g。
下列说法中正确的是( )
A. 该溶液中一定不含Ba2+ 、Mg2+、A13+、SiO32-、Cl-
B. 该溶液中一定含有K+、AlO2-、CO32-、Cl-
C. 该溶液是否有K+ 需做焰色反应(透过蓝色钴玻璃片)
D. 可能含有Cl-
难度: 困难查看答案及解析
-
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去)。下列说法错误的是
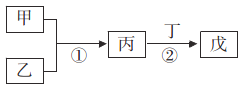
A. 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应
B. 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙可能是铜和稀硝酸
C. 若甲为硫磺燃烧产物,丁为水,则戊不可用于干燥甲
D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色
难度: 中等查看答案及解析
-
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为pg .cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的有
①
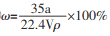 ②
②③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
难度: 中等查看答案及解析