-
下列家庭实验中不涉及化学变化的是:
A、用熟苹果催熟青香蕉 B、用少量食醋除去水壶中的水垢
C、用糯米、酒曲和水制甜酒酿 D、用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
难度: 中等查看答案及解析
-
下列叙述正确的是:
A、Li在氧气中燃烧主要生成Li2O2
B、将CO2通入溶有漂粉精的水溶液中可生成次氯酸
C、将SO2通入CaCl2溶液可生成CaSO3沉淀
D、将NH3通入热的CuSO4溶液中可使Cu2+还原成Cu
难度: 中等查看答案及解析
-
右图是一种染料敏化太阳能电池的示意图,电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
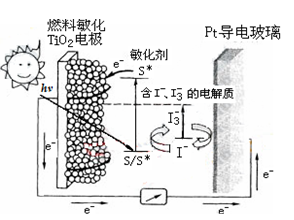
TiO2/S→TiO2/S*(激发态)
TiO2/S*→TiO2/S++e-
I3-+2e-→3I-
2TiO2/S++3I-→2TiO2/S+I3-
下列关于该电池叙述错误的是:
A、电池工作时,I-离子在镀铂导电玻璃电极上放电
B、电池工作时,是将太阳能转化为电能
C、电池的电解质溶液中I-和I3-的浓度不会减少
D、电池中镀铂导电玻璃为正极
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是:
A、过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O
B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D、NaHCO3溶液中加入过量的Ba(OH)2溶液2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是:
A、2.24LCO2中含有的原子数为0.3 ×6.02×1023
B、0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C、5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D、4.5g SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y,X与Z 位于同一主族.W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍。 下列叙述中不正确的是:
A、WX2分子中所有原子最外层都为8 电子结构
B、WX2、ZX2的化学键类型和晶体类塑都相同
C、WX2是以极性键结合成的非极性分子
D、原子半径大小顺序为X <W<Y<Z
难度: 中等查看答案及解析
-
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是:
A、V(NaOH)= 0时,c(W)=1 × 10-2 mol/L
B、V(NaOH)< 10 mL时,不可能存在c(Na+)=2 c(C2O42-)+ c(HC2O4-)
C、V(NaOH)= 10 mL时,c(W)= 1 × 10-7mol/L
D、V(NaOH)> 10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-)
难度: 中等查看答案及解析
-
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2 H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2 H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为:
[提示:①H2C2O4是二元弱酸;
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O]
A、0.008889 B、0.08000 C、0.1200 D、0.2400
难度: 中等查看答案及解析
