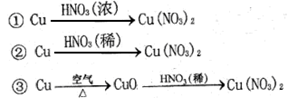
-
下列说法正确的是
A.根据物质的组成和性质特点,可以将物质分成混合物和纯净物,漂白粉、钢、水玻璃、液氨都为混合物
B.地沟油可用于提炼生物柴油,它和柴油同属于烃类物质
C.大豆蛋白、鸡蛋白分别溶于水所形成的分散系为胶体,在加热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质的性质都会改变并发生变性
D.李比希法可用于有机化合物组成中碳、氢元素质量分数的测定,同位素示踪法可用于研究化学反应历程机理
难度: 中等查看答案及解析
-
下列有关实验说法正确的是
A.在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、取2—3 次的实验平均值等措施,以达到良好的实验效果
B.纸上层析属于色谱分析法,其原理跟“毛细现象”相关,通常以滤纸作为惰性支持物,滤纸纤维吸附的水作为固定相
C.检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热,用稀硫酸进行酸化后再加入硝酸银溶液
D.酸式滴定管,碱式滴定管、移液管都是准确量取一定体积液体的仪器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程
难度: 中等查看答案及解析
-
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙是由X、Y、Z组成的盐。下列说法正确的是
A.原子半径:W>Y>Z,简单离子半径: Y>Z>W
B.YX 3的空间构型是三角锥型,而Y2X4的空间构型类似于乙烯的空间构型
C.测得乙的水溶液呈酸性,则溶液中乙盐阳离子浓度大于酸根离子浓度
D. W的氯化物熔点低,易升华,但水溶液能导电,由此推断它属于弱电解质
难度: 困难查看答案及解析
-
下列说法正确的是:
A.已知某温度下纯水中的c(H+)=2×l0-7mol.L-1,据此无法求出水中c(OH-)
B. 已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2.L-2
C.常温下
的溶液中存在Al3+、NH4+、Cl-、NO3-
D.已知:
共价键
C—C
C=C
C—H
H—H
键能/kJ·mol-1
348
610
413
436
由上表数据可以计算出反应
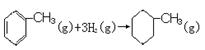 的焓变
的焓变难度: 困难查看答案及解析
-
发展混合动力车是实施节能减排的重要措施之一。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)电解液。镍氢电池充放电原理总反应式为:H2+2NiOOH
2Ni(OH)2。下列有关混合动力车的判断正确的是:
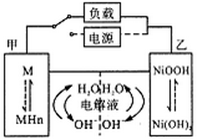
A.在上坡或加速时,乙电极周围溶液的pH将减小
B.在上坡或加速时,溶液中的K+向甲电极迁移
C.在刹车和下坡时,乙电极增重
D.在刹车和下坡时,甲电极的电极反应式为:2H2O+2e-
H2↑+2OH-
难度: 中等查看答案及解析
-
常温下,向一定体积的1mol.L-1的醋酸溶液中逐滴加入等浓度的氢氧化钠溶液,溶液中pOH和pH的变化如图所示,已知该条件下醋酸的电离程度为0.4%,则下列说法不正确的是
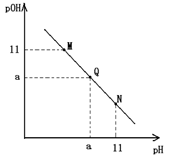
A.a为7
B.Q点的水的电离程度在整条曲线中最大
C.M和Q之间(不含Q)的溶液离子浓度排序都满足c(CH3COO-)>c(Na+)
D.三点所代表的溶液导电能力,N最大,M最小
难度: 中等查看答案及解析
-
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤
操作
现象
1
用pH试纸检验
溶液的pH大于7
2
向溶液中滴加氯水,再加入CCl4振荡,静置
CCl4层呈橙色
3
分液,向上层溶液中加入Ba(NO3)2溶液和稀HNO3
有白色沉淀产生
4
过滤,向滤液中加入AgNO3溶液
有白色沉淀产生
下列结论正确的是
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑥
C.不能确定的离子是①
D.不能确定的离子是③⑤
难度: 困难查看答案及解析