-
已知:W是组成信息高速公路骨架的元素之一,且X、Y、Z、W在元素周期表中的位置如图所示。下列说法正确的是( )
X
Y
Z
W
A.最高正化合价:Z>X=W>Y
B.原子半径:Y>X>W>Z
C.最高价氧化物对应水化物的酸性:Z<X<W<Y
D.最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W
难度: 中等查看答案及解析
-
下列各组中两种气体所含的原子数一定相等的是( )
A.温度相同,体积相同的O2和N2
B.质量相等,密度不等的N2和CO
C.体积相等,密度相等的CO和C2H4
D.压强相同、体积相同的N2和O2
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.NH4HCO3溶液中加入少量稀NaOH溶液:NH4++OH﹣=NH3•H2O
B.FeBr2溶液中通入足量的氯气:2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O
D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3﹣+Br2+H2O=3H++2Br﹣+SO42-
难度: 困难查看答案及解析
-
常温下,下列三个反应均能发生:X2+2W2+=2X﹣+2W3+;Z2+2X﹣=2Z﹣+X2;2W3++2Y﹣=2W2++Y2.则在相同条件下,下列三个反应:①Y2+2X﹣=2Y﹣+X2;②Z2+2Y﹣=2Z﹣+Y2;③2W3++2Z﹣=2W2++Z2也能发生的是( )
A.只有① B.只有② C.①和② D.②和③
难度: 中等查看答案及解析
-
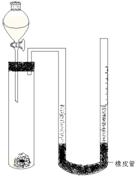
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )

A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
B.若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
D.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
难度: 中等查看答案及解析
-
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )

A.V=224
B.样品中Fe的质量为2.14g
C.样品中CuO的质量为3.52g
D.未氧化前Fe元素的质量分数约为41.2%
难度: 困难查看答案及解析
-
实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在pH=5时沉淀完全)。其中分析错误的是( )

A.步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B.步骤②可用氯水、硝酸等强氧化剂代替H2O2
C.步骤③用 CuCO3代替CuO也可调节溶液的pH
D.步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作2-3次
难度: 困难查看答案及解析
-
已知CN﹣(氢氰酸根离子)SCN﹣(硫氰酸根离子)和Cl﹣有相似之处:两个﹣CN原子团或两个﹣SCN原子团可分别构成氰分子(CN)2和硫氰分子(SCN)2。(CN)2和(SCN)2的性质和Cl2有性质有相似之处,且常温常压下是气体,下列物质间反应的化学方程式错误的是( )
A.二氧化锰和HSCN溶液加热反应:MnO2+4HSCN
Mn(SCN)2+(SCN)2↑+2H2O
B.(CN)2和氢氧化钾溶液反应:(CN)2+2KOH═KCN+KCNO+H2O
C.碘晶体投入HCN溶液中:I2+2HCN═2HI+(CN)2
D.(SCN)2和水反应:(SCN)2+H2O
HSCN+HSCNO
难度: 困难查看答案及解析
-
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:
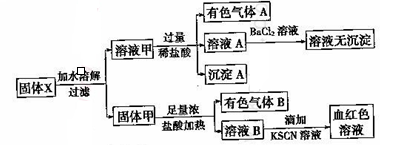
根据上述实验,以下说法正确的是( )
A.溶液甲中一定含有K2SiO3、NaNO2
B.无法判断溶液中是否有K2SO3
C.气体A和气体B-定为混合物
D.原混合物中一定有Fe2O3
难度: 困难查看答案及解析
-
下列变化中可以说明SO2具有漂白性的是( )
A.SO2通入高锰酸钾酸性溶液中红色褪去
B.SO2通入品红溶液中红色褪去
C.SO2通入溴水溶液中红棕色褪去
D.SO2通入氢氧化钠与酚酞的混合溶液中红色褪去
难度: 简单查看答案及解析
-
FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示。下列说法错误的是( )
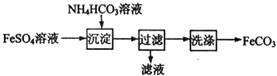
A.可利用KSCN溶液检验FeSO4溶液是否变质
B.沉淀过程中有CO2气体放出
C.过滤搡作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D.产品FeCO3在空气中高温分解可得到纯净的FeO
难度: 中等查看答案及解析
-
将容积为50mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL。则原混合气体中NO2和O2体积比可能是( )
A.9:1 B.18:7 C.41:9 D.1:1
难度: 中等查看答案及解析
-
NaCl溶液中可能混有杂质NaOH、NaHCO3、Na2CO3中的一种或二种,为测定溶液中混有的杂质成分,可进行如下实验操作:分别取二份等体积混合液,用盐酸的标准液 (0.10 mol/L)滴定,以酚酞或甲基橙为指示剂,达到终点时消耗盐酸的体积分别为V1和V2,且V2>V1。则NaCl溶液中混有的杂质可能为( )
A.NaOH B.Na2CO3 C.Na2CO3、NaHCO3 D.NaOH、Na2CO3
难度: 困难查看答案及解析
-
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加人3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。则下列叙述中不正确的是( )
A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL
B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C.参加反应的金属的总质量为9.6 g>m>3.6 g
D.当金属全部溶解时收集到NO气体的体积一定为2.24 L。
难度: 极难查看答案及解析
-
将质量分数为a%,物质的量浓度为c1mol·L﹣1的稀H2SO4蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2mol·L﹣1,则c1和c2的数值关系是( )
A.c2=c1 B.c2<2c1 C.c2>2c1 D.c2=2c1
难度: 困难查看答案及解析