-
下列有关化学用语使用正确的是
A. 质子数为17、中子数为20的氯原子:
B. NH4Br的电子式:
C. 氯分子的电子式:
D. HBr的电子式:
难度: 中等查看答案及解析
-
化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
难度: 中等查看答案及解析
-
下列措施不能达到节能减排目的的是
A.利用太阳能制氢燃料 B.用家用汽车代替公交车
C.利用潮汐能发电 D.用节能灯代替白炽灯
难度: 简单查看答案及解析
-
13153I是常规核裂变产物之一,可以通过测定大气或水中13153I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关13153I的叙述中错误的是( )
A. 13153I的化学性质与12753I相同
B. 13153I的原子序数为53
C. 13153I的原子核外电子数为78
D. 13153I的原子核内中子数多于质子数
难度: 简单查看答案及解析
-
下列关于化学键的叙述,正确的一项是
A. 离子化合物中一定含有离子键
B. 单质分子中均不存在化学键
C. 离子化合物中一定不存在共价键
D. 含有共价键的化合物一定是共价化合物
难度: 中等查看答案及解析
-
下列关于浓硝酸的叙述正确的是
A. 浓硝酸有氧化性,稀硝酸无氧化性
B. 常温下能用铝制容器盛放浓硝酸
C. 浓硝酸在常温下可迅速与铜片反应放出一氧化氮气体
D. 浓硝酸不需要用棕色试剂瓶保存
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
难度: 中等查看答案及解析
-
对化学反应限度的叙述,错误的是
A. 任何可逆反应都有一定的限度
B. 化学反应的限度与时间的长短无关
C. 化学反应的限度是不可改变的
D. 化学反应达到限度时,正逆反应速率相等
难度: 中等查看答案及解析
-
①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②有气泡逸出;③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B. 无色溶液:Ca2+、H+、Cl-、HSO3-
C. 酸性溶液中可能大量存在Na+、K+、SO42-、I-
D. c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
下列指定反应的离子方程式错误的是
A. 氯气溶于水:Cl2 + H2O ═ 2H+ + Cl- + ClO-
B. 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2- + CO2 + 2H2O ═ Al(OH)3↓ + HCO3-
C. 少量Cl2通入KI溶液中:Cl2 + 2I- ═ 2Cl- + I2
D. Cu溶于稀HNO3:3Cu + 8H+ + 2NO3- ═ 3Cu2+ + 2NO↑ + 4H2O
难度: 中等查看答案及解析
-
对于Cu—Zn—稀H2SO4构成的原电池装置中,当导线中有1mol电子通过时,理论上两极的变化是
①锌片溶解了32.5g ②锌片增重32.5g③铜片上析出1g H2 ④铜片上析出1mol H2
A. ①③ B. ①④ C. ②③ D. ③④
难度: 简单查看答案及解析
-
对于化学反应3W(g)+2X(g)
4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
难度: 简单查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
溶液呈红色
稀HNO3将Fe氧化为Fe3+
B
向溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X中一定含有SO42-
C
Al箔插入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关原子结构和元素周期律的表述正确的是
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A. ①② B. ①③ C. ②④ D. ③④
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,则下列说法正确的是

A. W的氧化物对应的水化物为强酸
B. 由Z与Y组成的物质在熔融时不能导电
C. W得电子能力比Q强
D. X有多种同素异形体,而Y不存在同素异形体
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A. 元素W、X的氯化物中,各原子均满足8电子的稳定结构
B. 元素X与氢形成的原子比为1:1的化合物有很多种
C. 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D. 元素Z可与元素X形成共价化合物XZ2
难度: 困难查看答案及解析
-
根据下表信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. R与T形成的化合物RT3中,各原子均满足8电子的稳定结构
B. 单质与稀盐酸反应产生氢气的剧烈程度为L<Q
C. M与T形成的化合物具有两性
D. L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
如图是稀酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是

A.稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)= Fe(NO3)3 + 3NO2↑+ 3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱
难度: 中等查看答案及解析
-
称取(NH4)2SO4和NH4HSO4混合物样品7.24 g,加入含0.1 mol NaOH的溶液,完全反应,生成NH31792 mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为
A.1:1 B.1:2 C.1.87:1 D.3.65:1
难度: 简单查看答案及解析
-
当三份铜粉分别与足量的稀硝酸、浓硝酸、热的浓硫酸反应后收集到的气体在相同状况下体积相等时,三份铜粉的质量比为
A . 3:1:2 B . 3:2:2 C . 1:1:2 D . 1:3:2
难度: 中等查看答案及解析
-
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是
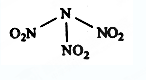
A.分子中N、O间形成的共价键是非极性键 B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性 D.15.2g该物质含有6.02×1022个原子
难度: 中等查看答案及解析
-
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A.Zn为电池的正极
B.正极反应式为2FeO42−+10H++6e−=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时
向负极迁移
难度: 简单查看答案及解析
-
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是
A.锂电极作电池负极,放电过程中发生还原反应
B.1 mol SOCl2发生电极反应转移的电子数为4 mol
C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2
D.组装该电池必须在无水、无氧的条件下进行
难度: 中等查看答案及解析
-
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图。下列有关氢氧燃料电池的说法不正确的是 ( )
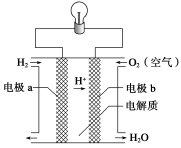
A.该电池中电极b是正极
B.外电路中电子由电极b通过导线流向电极a
C.该电池的正极反应为O2+4H++4e-=2H2O
D.该电池的总反应:2H2+O2=2H2O
难度: 中等查看答案及解析