-
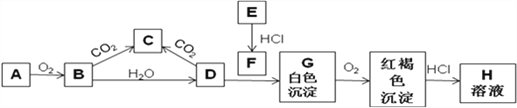
有a、b、c、d、e五种气体,进行如表所示的四组实验。根据相关实验现象,可判断出a、b、c、d、e依次可能是
实验操作
实验现象
(1)a和b混合
气体变成红棕色
(2)c和d混合
产生白烟
(3)c和e分别通入少量溴水中
溴水都变成无色透明溶液
(4)b和e分别通入硫化氢溶液中
都产生淡黄色沉淀
A. O2、NO、HCl、NH3、CO2 B. O2、NO、NH3、HCl、SO2
C. NO、O2、NH3、HCl、SO2 D. HCl、CO2、NH3、H2S、SO2
难度: 中等查看答案及解析
-
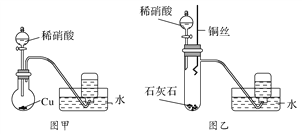
已知NH4CuSO3与足量的稀硫酸混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. NH4CuSO3中S元素被氧化
C. 刺激性气味的气体是氨气
D. 1 mol NH4CuSO3完全反应转移0. 5 mol电子
难度: 中等查看答案及解析
-
下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是( )
A. 碘水 B. 氯化铁溶液 C. 溴化钠溶液 D. 二氧化氮气体
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+
B. 某溶液中加入新制氯水,再加KSCN溶液,溶液呈血红色,一定有Fe2+
C. 某溶液中加入BaCl2溶液,产生白色沉淀,说明原溶液中一定存在SO42-
D. 某固体中加入稀盐酸,产生无色无味且能使澄清石灰水变浑的气体,说明该固体一定含有CO32-
难度: 中等查看答案及解析
-
“类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验才能确定其是否正确。下列几种类推结论中错误的是( )
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③Al(OH)3、Cu(OH)2受热易分解;Fe(OH)3受热也易分解
④不能用电解熔融的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁
A. ①④ B. ②④ C. ①②④ D. ①②③④
难度: 中等查看答案及解析
-
下列有关物质用途的说法中,正确的是( )
①SiO2可用来制造半导体元件 ②SO2 可用于漂白纸浆和干果防腐剂
③Al(OH)3可用于治疗胃酸过多 ④SiO2、Na2CO3和CaCO3可用于制玻璃
⑤Na2O2 可用作潜水艇O2 来源 ⑥K2FeO4可用于饮用水的杀菌消毒和净化
⑦NaOH溶液用于雕刻玻璃上的纹饰 ⑧Na2SiO3可用作木材防火剂
A. 7个 B. 6个 C. 5个 D. 4个
难度: 中等查看答案及解析
-
下列表格中各项都正确的组是( )
碱
盐
电解质
非电解质
混合物
A
烧碱
小苏打
BaSO4
干冰
水玻璃
B
纯碱
CaCO3
NH3•H2O
Fe
漂白粉
C
明矾
食盐
石墨
醋酸
冰水
D
KOH
CuSO4
熔融MgCl2
氯水
铝热剂
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列叙述与胶体的性质无关的是
A. 向氢氧化铁胶体中逐滴加入稀盐酸,开始产生红褐色沉淀,后来沉淀逐渐溶解并消失
B. 当日光从窗隙射入暗室时,观察到一束光线
C. 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
D. 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘粒子带电荷
难度: 简单查看答案及解析
-
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH4+、SO42-、CO32-、K+ B. Na+、Ba2+、Ca2+、HCO3-
C. Mg2+、SO42-、K+、Cl- D. K+、Cl-、Na+、SO42-
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 标况下,22.4L的SO3分子含硫原子的数目为NA
B. 常温常压下,200g质量分数为17% 的H2O2溶液中含氧原子数目为NA
C. 7.1g氯气与足量NaOH溶液反应制备漂白液转移电子数为0.1NA
D. 1.8g的NH4+ 离子中含有的电子数1.1NA
难度: 中等查看答案及解析
-
下列实验操作或数据合理的是( )
A. 工业上常用热还原法冶炼铁和钠
B. 用NaOH溶液能一次鉴别分别含有Mg2+、Cu2+、和Al3+的三种盐溶液
C. 从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏
D. 量取16.80mLNa2CO3溶液可选用规格为20mL的量筒
难度: 中等查看答案及解析
-
下列试剂的保存方法错误的是( )
A. 实验室少量的钠保存在煤油中 B. 新制的氯水保存在棕色玻璃瓶中
C. 氢氟酸(HF)保存在无色的玻璃瓶中 D. 氢氧化钠溶液保存在带橡皮塞的玻璃瓶中
难度: 简单查看答案及解析
-
下列四个反应中水起的作用与其他不相同的是( )
①Cl2+H2O ②Na+H2O ③NO2+H2O ④Na2O2+H2O
A.① B.② C.③ D.④
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. NH4HCO3溶液中加入少量NaOH 稀溶液: NH4++OH-=NH3·H2O
B. Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+ SO2+H2O= HClO+HSO3-
C. 酸性高锰酸钾溶液中滴入少量过氧化氢:2MnO4-+7H2O2+6H+= 2Mn2++ 6O2↑+10H2O
D. 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析
-
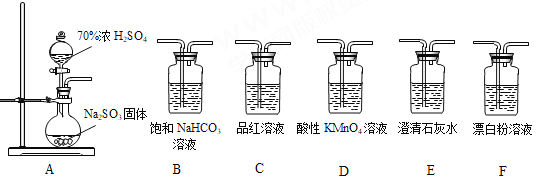
关于下列各实验装置的叙述中,不正确的是

A. 装置①可用于分离C2H5OH和H2O的混合物
B. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
难度: 中等查看答案及解析
-
标准状况下,4.48L的C2H4和C2H6混合气体充分燃烧得到CO和CO2混合气体的密度为1.429g/L,则其中CO的体积为( )
A. 1.12L B. 2.24L C. 4.48L D. 6.72L
难度: 中等查看答案及解析
-
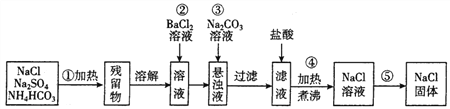
某学习小组按如下实验流程从海带中提取碘单质。
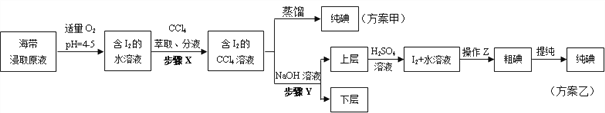
已知:3I2+6NaOH=5NaI+NaIO3+3H2O,根据以上流程,判断下列说法不正确的是( )
A. 方案甲采用蒸馏法不合理主要由于碘易升华,会导致碘的损失
B. 步骤X中,萃取后分液漏斗内观察到的现象为液体分上下两层,上层呈紫红色
C. 步骤Y中,应控制NaOH溶液的浓度和体积
D. 步骤Y的目的将碘转化成离子进入水层
难度: 困难查看答案及解析
-
现有Fe、Al、Si三种单质的混合物,取一半投入足量的NaOH溶液中,将剩余的一半投入足量的稀硫酸中,若经测量两次实验产生的气体质量相等,则原混合物中Fe、Al、Si三种单质的物质的量之比可能为( )
A. 6:4:3 B. 1:1:1 C. 2:3:4 D. 3:7:6
难度: 困难查看答案及解析
-
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法错误的是( )
硫酸化学纯(CP)
(500mL)
品名: 硫酸
化学式: H2SO4
相对分子质量: 98
密度: 1.84g/cm3
质量分数: 98%
A. 该硫酸试剂的物质的量浓度为18.4mol·L-1
B. 该硫酸与等体积的水混合所得溶液的质量分数大于49%
C. 配制200mL 4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D. 常温下,将2.7gAl投入足量该硫酸中可得到标准状况下的氢气3.36L
难度: 困难查看答案及解析
-
为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
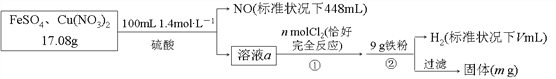
下列叙述中不正确的是( )
A. n=0.02 B. m=3.2
C. V=2240 D. 原混合物中FeSO4的质量分数约为89%
难度: 困难查看答案及解析