-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.7.8g苯中含有C-C单键数目为0.3NA
B.标准状况下,2.24L的CHCl3中含有的C-H键数为0.1NA
C.1.4g C2H4和C3H8的混合物中含碳原子数为0.1 NA
D.13克溶有乙炔的苯乙烯,其所含的电子数目为7 NA
难度: 简单查看答案及解析
-
下到化学用语表示正确的是
A.H2O2的电子式:
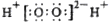
B.CH3CH2NO2与H2NCH2COOH互为同分异构体
C.氯乙烷结构简式:CH2ClCH2Cl
D.C2H4与C3H6一定互为同系物
难度: 中等查看答案及解析
-
下列化学用语中,正确的是
A.氯化钠的电子式为
B.镁的原子结构示意图为
C.氯化氢分子的形成过程可用电子式表示式:
D.重水的化学式为 21H2O(或D2O)
难度: 中等查看答案及解析
-
下列化学用语的表达正确的是( )
A.原子核内有 10 个中子的氧原子:
B.氢氧根离子的电子式:
C.基态 Cr 的价电子排布式为:3d44s2
D.某元素原子的电子排布图:

难度: 中等查看答案及解析
-
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法不正确的是( )

A.在甲中滴加丁可能发生反应:HCO3—+ Ba2++OH—= BaCO3↓+ H2O
B.溶液丙中还可以大量共存的离子有:I—、NO3—、SO42—
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH—(aq)═H2O(l)△H=-57.3kJ/mol
B.向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:
3NH4++Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
C.淀粉碘化钾溶液在空气中变蓝:4I—+O2+4H+═2I2+2H2O
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32—+6H++2MnO4—═5SO42—+2Mn2++3H2O
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列叙述错误的是( )
A.46gNO2和N2O4混合气体中含有原子总数为3NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应小于0.1NA
C.12g金刚石中含有的共价键数为2NA
D.2.1gDTO中所含中子数为NA
难度: 简单查看答案及解析
-
设NA表示阿伏伽德罗常数的值,下列判断正确的是
A.将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
B.标准状况下,22.4 L甲醇中含有的C—H的数目为3NA
C.25℃时,pH=2的硫酸溶液中,含有的H+的数目为0.01NA
D.5.6 g Fe与一定量稀硝酸反应,Fe完全溶解时失去的电子数为3NA
难度: 简单查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到的气体其物质的量为amol,向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1(在相同条件下),则a可能为( )
A.0.40 B.0.60 C.0.70 D.0.80
难度: 简单查看答案及解析
-
向100mLFeBr2溶液中通入标况下Cl23.36L,Cl2全部被还原,最终测得溶液中c(Br-)是c(Cl-)的一半,则原FeBr2溶液的物质的量浓度(mol·L-1)是( )
A.0.75 B.1.5 C.2 D.3
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.附着在试管内壁上的AgOH固体可用氨水溶解而洗去
B.可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液
C.向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液
D.加热碘单质,产生紫色蒸气,这个过程克服了范德华力
难度: 简单查看答案及解析
-
为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W0 g样品进行实验,下列实验方法所对应的实验方案和测量数据最合理(除W0外)的是( )
实验方法
实验方案
测量数据
A
滴定法
将样品配成100 mL溶液,取10 mL,加入甲基橙,用标准盐酸滴定
消耗盐酸的体积
B
量气法
将样品与盐酸反应,生成的气体全部被碱石灰吸收
碱石灰增重
C
重量法
样品放入烧瓶中,置于天平上,加入足量盐酸
减轻的质量
D
量气法
将样品与盐酸反应,气体通过排水量气装置量气
排水体积
难度: 中等查看答案及解析
-
将11.2g铜粉和镁粉的混合物分成两等份,其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2.24L;将另一份在空气中充分加热,最后得到mg固体。下列有关说法:①c(HNO3)=2mol·L-l②c(HNO3)=0.5mol·L-1③m=8.0④m=7.2其中正确的是( )
A.①④ B.①③ C.②④ D.②③
难度: 简单查看答案及解析
-
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是( )
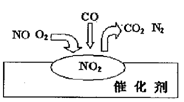
A.NO2是该过程的最终产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO+O2+4CO
4CO2+N2
难度: 中等查看答案及解析
-
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是( )
A.只有①或②
B.只有②或④
C.只有①或②或③
D.上述四种物质中任意一种
难度: 中等查看答案及解析
-
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑,A和X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,下列有关说法正确的是( )
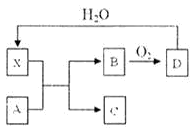
A.X能使蔗糖变黑主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最终一定有白色沉淀产生
D.工业上,B转化为D的反应需使用催化剂
难度: 中等查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是 ( )
序号
①
②
③
④
⑤
甲
CO2
HCl
CO2
NO2
CO2
乙
SO2
CO2
SO2
SO2
NH3
丙
石灰水
石灰水
Ba(NO3)2
BaCl2
CaCl2
A.②③④ B.①②③④ C.①③④ D.②③④⑤
难度: 中等查看答案及解析
-
将盛有N2和NO2(无N2O4)混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为原来的一半,则原混合气体中N2和NO2的体积比是( )
A.1:1 B.1:2 C.1:3 D.3:1
难度: 中等查看答案及解析
-
对于实验I-IV的实验现象预测正确的是( )

A.实验I:逐滴滴加盐酸时,试管中立即产生大量气泡.
B.实验II:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
难度: 简单查看答案及解析
-
化学与工农业生产和人类生活密切相关。下列说法中正确的是( )
A.酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的
B.饱和氯水既有酸性又有漂白性,加入NaHCO3后漂白性减弱
C.烧融烧碱应选用的器皿是铁坩埚而不是石英坩埚、普通玻璃坩埚或陶瓷坩埚
D.用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体
难度: 中等查看答案及解析

