-
向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag..下列结论错误的是( )
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+的物质的量比为1:2
D.1molFe可还原2molFe3+难度: 中等查看答案及解析
-
将SO2通入略显酸性的Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀,在上述一系列变化过程中,最终被还原的微粒是( )
A.NO3-
B.SO2
C.Fe2+
D.Fe3+难度: 中等查看答案及解析
-
下列溶液中能够区别SO2和CO2气体的是①澄清石灰水 ②H2S溶液 ③KMnO4酸性溶液 ④氯水 ⑤品红溶液( )
A.①②③
B.②③④
C.除①以外
D.全部难度: 中等查看答案及解析
-
下列叙述正确的是( )
①氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚
②氧化铁常用作红色油漆和涂料
③硅酸钠是制备硅胶和木材防火剂的原料
④用纯碱、石灰石、石英为原料可制普通玻璃
⑤石灰石、高岭石、石英和水晶的主要成份都是SiO2.
A.①③④⑤
B.②③④⑤
C.①②④⑤
D.①②③④难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是( )
A.1molNa与足量O2反应生成Na2O或Na2O2均失去NA个电子
B.1molAl分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个
C.各5.6g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
D.2.7g铝与足量的NaOH溶液反应,转移的电子总数为NA难度: 中等查看答案及解析
-
A~D是含同一种元素的四种物质,相互之间有如图所示转化关系,其中A是单质,D是最高价氧化物的水化物.那么A可能是( )

A.S
B.Cl2
C.Fe
D.Si难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强
B.陶瓷、玻璃、水泥容器都能贮存氢氟酸
C.石灰抹墙、水泥砌墙的硬化过程原理相同
D.玻璃窑中出来的气体的主要成分是二氧化碳难度: 中等查看答案及解析
-
把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.O2
B.NO2
C.NO2和O2
D.NO2和NO难度: 中等查看答案及解析
-
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )
A.3:2
B.2:1
C.3:4
D.4:3难度: 中等查看答案及解析
-
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )
A.定性检验SO32-,将BaCl2溶液用HNO3酸化
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe2+时,用硝酸酸化
D.检验溶液中是否含有SO42-时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液难度: 中等查看答案及解析
-
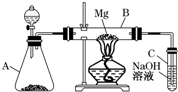
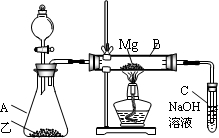
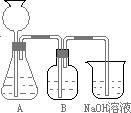
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
气体 a b c ① NO2 浓硝酸 铜片 浓硫酸 ② SO2 浓硫酸 Fe 浓硫酸 ③ NH3 浓氨水 生石灰 碱石灰 ④ Cl2 浓盐酸 MnO2粉末 浓硫酸 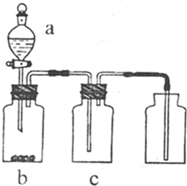
A.①
B.②
C.③
D.④难度: 中等查看答案及解析
-
200℃时,11.6g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6g,则原混合物的平均式量为( )
A.5.8
B.11.6
C.23.2
D.46.4难度: 中等查看答案及解析
-
将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为( )
A.NO2
B.N2O2
C.N2O
D.N2O4难度: 中等查看答案及解析
-
将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
A.气体A为SO2和H2的混合物
B.反应中共消耗Zn97.5g
C.气体A中SO2和H2的体积比为4:1
D.反应中共转移3mol电子难度: 中等查看答案及解析
-
工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO+2HCl═CuCl2+H2O FeO+2HCl═FeCl2+H2O; 已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是( )
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化成Fe3+,再调整pH在3~4
D.通入硫化氢,使Fe2+直接沉淀难度: 中等查看答案及解析
-
现有等体积混合而成的4组气体.①NO2+NO、②NO2+O2、③HCl+N2、④Cl2+SO2.现将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高 度分别为h1、h2、h3、h4,则高度关系是( )
A.h4>h2>h3>h1
B.h4>h3>h2>h1
C.h2>h3>h1>h4
D.h3>h2>h1>h4难度: 中等查看答案及解析
-
盛有12mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是( )
A.1.2mL
B.2.4mL
C.3.6mL
D.4.8mL难度: 中等查看答案及解析
-
在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3,可使铜粉溶解的是( )
A.②④
B.①②
C.②③④
D.①③④难度: 中等查看答案及解析
-
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是 ①实验室收集氨气采用图所示装置 ②实验室中做氯气与钠的反应实验时采用图所示装置 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验 ④实验室中采用图所示装置进行铜与稀硝酸的反应( )

A.②③④
B.①②③
C.①②④
D.①③④难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mL
B.45mL
C.30mL
D.15mL难度: 中等查看答案及解析
-
下列示意图与对应的反应情况正确的是( )
A. 含0.01molKOH和0.01molCa(OH)2的混合溶液中缓慢通入CO2
含0.01molKOH和0.01molCa(OH)2的混合溶液中缓慢通入CO2
B. NaHSO4溶液中逐滴加入Ba(OH)2溶液
NaHSO4溶液中逐滴加入Ba(OH)2溶液
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D. NaAlO2溶液中逐滴加入盐酸
NaAlO2溶液中逐滴加入盐酸 难度: 中等查看答案及解析
-
将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )

A.原合金质量为0.92g
B.标准状况下产生氢气896mL
C.图中m值为1.56g
D.图中V2为60mL难度: 中等查看答案及解析