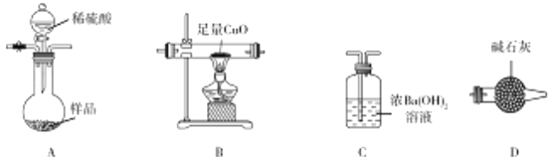
-
MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MaSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:_________________________________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s) Mn0(s)+CO2(g) △H1 K1
Mn0(s)+CO2(g) △H1 K1
②2MnO(s)+O2(g) 2MnO2(s)△H2 K2
2MnO2(s)△H2 K2
③2MnCO3(n) +O2(g) 2MnO2(s) +2CO2(g) △H3 K3
2MnO2(s) +2CO2(g) △H3 K3
△H3=________用△H1,△H2表示);K3=________用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H3________0(填“>"“<"或“=")。
(4)在密闭容器中投入足量的MnCO3,一定条件下发生反应MnCO3(s) MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
①温度、压强对MnCO3分解率的影响如图所示:
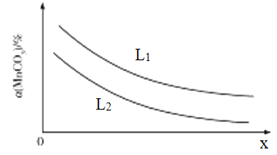
比较:L1__________L2(填“>"“<”或“=")。
②保持温度不变,将容器休积扩大至原来的2倍,则ρ(CO2)的变化范围是____________。
③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量一定不变的是____(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)一定温度下,在容积为2L的恒容密闭容器中加入足量的MnCO3(s)和5molO2,发生反应:2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g),CO2 以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
2MnO2(s)+2CO2(g),CO2 以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
-
已知钒的化合物在水溶液中存在多种离子形式:V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)、VO43-(无色)、V5O143-(红棕色)等。
(1)如果向酸性的VSO4溶液中滴加高锰酸钾溶液,溶液出现的颜色变化是:紫色→绿色(I)→蓝色→绿色(Ⅱ)→黄色。则出现绿色(I)时发生反应的离子方程式是_________________________。
(2)向酸性(VO2)2SO4溶液中加入NaOH溶液调节pH,随着NaOH溶液的加入,溶液先出现红棕色,继续加入NaOH溶液,最终变为无色。写出(VO2)2SO4生成红棕色溶液,红棕色溶液变为无色溶液时发生反应的离子方程式:___________________________________________________________。
(3)向VO2+的溶液中加入氨水可以得到NH4VO3(微溶于水);NH4VO3受热最终会分解生成钒的氧化物。
①室温下,NH4VO3在水中的Ksp曲线如图Ⅰ所示,则其值为________。
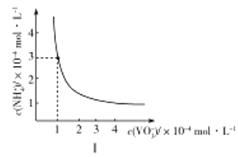
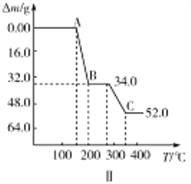
②热重分析可探究化学变化的历程,某研究小组取234gNH4VO3进行探究,焙烧过程中固体质量的减小量随温度的变化曲线如图Ⅱ所示,则B的化学式是__________,C的化学式是__________。
(4)已知2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O。用硫酸酸化的H2C2O4溶液测定(VO2)2SO4溶液中钒含量的步骤为:取10.0mL0.1mol·L-1H2C2O4溶液于锥形瓶中,将待测液盛放在滴定管中;滴定到终点时,消耗待测液的体积为10.0mL.
①是否需要加入指示剂?________________。
②(VO2)2SO4溶液中钒的含量为________g·L-1。
-
有机玻璃(PMMA)广泛应用于生活。以石油化工产品A为主要原料合成PMMA的一种工艺流程如下(部分产物和条件省略):
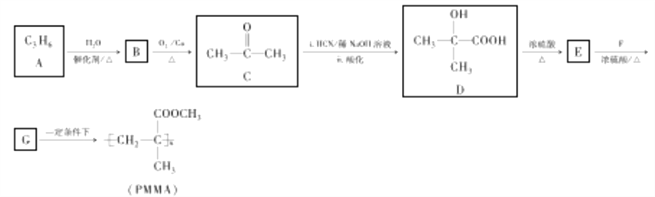
(1)B的化学名称为________________。
(2)E的结构简式为________,其核磁共振氢谱显示为________组峰,峰面积之比为________。
(3)由E生成G的反应类型为__________。G中官能团名称为__________。
(4)写出A生成B的化学方程式:_________________________________________________。
(5)T是G的同分异构体,1molT与足量银氨溶液反应最多生成4molAg。T的结构有________种(不含立体结构)。
(6)参照上述流程,以 为原料(其他原料自选),设计合成
为原料(其他原料自选),设计合成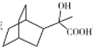 的路线:_______。
的路线:_______。
+NaCN
+NaBr B.
+Br2
+CH3OH
+H2O D.
+H2O
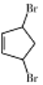
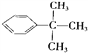 ,它的二氯代物有(不考虑立体结构)( )
,它的二氯代物有(不考虑立体结构)( )



 的路线:_______。
的路线:_______。