-
下列危险化学品标志中表示腐蚀品的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是( )
A. CaO B. NaHCO3 C. NaOH D. Na2CO3
难度: 简单查看答案及解析
-
下列反应可用离子方程式“H++OH− = H2O” 表示的是( )
A. NaHSO4溶液与Ba(OH)2溶液混合 B. NaHSO4溶液与KOH溶液混合
C. NaHCO3溶液与NaHSO4溶液混合 D. HCl溶液与氨水混合
难度: 简单查看答案及解析
-
下列关于胶体的叙述不正确的是( )
A. 溶液和胶体的本质区别是否有丁达尔效应
B. 向氢氧化铁胶体中缓缓滴加稀硫酸,先产生沉淀,进而沉淀溶解
C. 用半透膜渗析的方法,可以分离胶体和溶液
D. 水泥厂、面粉厂通常利用胶体电泳进行高压静电除尘
难度: 简单查看答案及解析
-
表中对于相关物质的分类全部正确的一组是( )
编号
碱性氧化物
酸性氧化物
非电解质
强电解质
A
Na2O
CO2
NH3
醋酸铵
B
Na2O2
SO2
乙醇
NaHCO3
C
Al2O3
SO3
CO2
Fe(OH)3
D
Fe3O4
CO
Cl2
NH4Cl
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. NaHCO3具有微弱的碱性,可作为治疗胃穿孔等胃病的一种药剂
B. 利用焰色反应鉴别钾时,可直接观察火焰的颜色
C. 钠的化学活泼性很强,少量的钠可保存在有机溶剂CCl4中
D. Al2O3可用于制作高温材料,Fe2O3可用于制造防锈漆
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A. pH=1的溶液中:Na+、K+、MnO4-、CO32-
B. 0.1 mol·L –1NH4HCO3溶液中:K+、Na+、NO3-、Cl-
C. 使酚酞变红的溶液中:Mg2+、Cu2+、SO42-、NO3-
D. 0.1 mol·L –1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 中等查看答案及解析
-
下列有关仪器的使用方法或实验操作正确的是( )
A. 蒸馏过程中发现忘记加沸石,应冷却后再加入沸石,重新加热蒸馏
B. 用苯萃取I2水后,先将I2的苯溶液从分液漏斗下口放出,再从上口放水
C. 容量瓶、分液漏斗、长颈漏斗,使用前均需要验漏
D. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
难度: 中等查看答案及解析
-
下列实验能够达到实验目的的是( )




A. A B. B C. C D. D
难度: 中等查看答案及解析
-
三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法不正确的是( )
A. 同温同压时,决定气体体积大小的是气体的物质的量
B. 同温同压时,同质量的三种气体,气体密度最小的是X
C. 同温同压时,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1mol
D. 同温下,体积相同的两容器分别充2gY气体和lgZ气体,则其压强比为4:1
难度: 中等查看答案及解析
-
下列有关物质鉴别的方法描述不正确的是( )
A. 无需其他试剂即可鉴别:稀盐酸与Na2CO3溶液
B. 用CO2鉴别:NaAlO2溶液和CaCl2溶液
C. 用澄清石灰水鉴别:Na2CO3和NaHCO3两种无色溶液
D. 用NaOH溶液一次性鉴别:MgCl2、AlCl3、CuCl2、FeCl2和FeCl3五瓶盐溶液
难度: 中等查看答案及解析
-
下列有关鉴定和除杂的说法正确的是( )
A. 向某溶液中滴加足量盐酸,若产生使澄清石灰水变浑浊的气体,溶液中一定含有CO32-
B. 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色,该溶液中一定含有Fe2+
C. 镁粉中混有少量Al粉,可加入过量NaOH溶液充分反应,过滤、洗涤、干燥
D. Cu 粉中含有的少量杂质 Fe ,可加入 FeCl3 溶液除去
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 120克NaHSO4固体含有离子数目为3NA
B. 总质量为1g的O2与N2混合气体含有的电子数为0.5NA
C. Na2O2与CO2反应时,每产生1 mol O2转移电子数为NA
D. 向含有FeI2的溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子数目为NA
难度: 中等查看答案及解析
-
用如图浓硫酸配制稀硫酸,下列说法正确的是( )

A. 若需要配制200mL1.00 mol·L –1的稀硫酸,通过计算后,用10mL量筒量取9.20mL浓硫酸
B. 浓硫酸与等质量的水混合后冷却,所得溶液的浓度大于9.2 mol·L –1
C. 若定容时加水超过刻度线后,应用胶头滴管吸出多余的液体
D. 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
难度: 简单查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实 验
现 象
结 论
A.
将酸性高锰酸钾加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
酸性高锰酸钾将Fe氧化为Fe3+
B.
将铜粉加入1.0 mol·L –1 FeCl3溶液
固体溶解,溶液渐变蓝
金属铁比铜活泼
C.
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D.
将少量FeCl3固体加入Mg(OH)2悬浊液中
白色的悬浊液逐渐变成红褐色
Fe(OH)3比Mg(OH)2溶解度更小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A. Fe(OH)3溶液中加入过量的HI(还原性强酸)溶液:2Fe(OH)3+6H+ = 2Fe3+ + 6H2O
B. 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+2AlO2-+6H2O=2Al(OH)3↓+CO32-
C. 明矾[KAl(SO₄)₂·12H₂O]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-= 2BaSO4↓+Al(OH)3↓
D. 向等物质的量浓度的NaOH和Na2CO3的混合液中加入过量稀盐酸:OH-+CO32-+3H+=CO2↑+2H2O
难度: 中等查看答案及解析
-
在硫酸铝、硫酸钾和明矾的混合溶液中,SO42-的离子浓度为0.40 mol·L –1,当加入等体积0.40 mol·L –1 KOH 溶液时,生成的沉淀恰好完全溶解,则反应后溶液中K+的物质的量浓度是(溶液混合后体积变化忽略不计)( )
A. 0.25mol·L-1 B. 0.45 mol·L-1
C. 0.50 mol·L-1 D. 0.90 mol·L-1
难度: 中等查看答案及解析
-
锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,产物有硝酸锌、X和水,则X可能是( )
A. NO B. N2O C. N2O3 D. NO2
难度: 中等查看答案及解析
-
下列图像均为实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系图,则其中正确的是( )
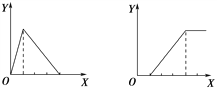
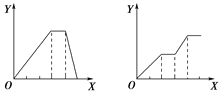
A B C D
A. 向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 向NaAlO2溶液中逐滴滴加稀盐酸至过量且边滴边振荡
C. 向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 向等物质的量浓度的NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
难度: 困难查看答案及解析
-
现有Fe、FeO、Fe2O3的混合物粉末3.44克,加入含0.1molHCl的盐酸恰好完全溶解,并收集到气体22.4mL(标准状况)。向反应后的溶液滴加KSCN,无明显变化。若将1.72克该混合物在高温下与足量的CO充分反应后,残留固体的质量为( )
A. 1.4克 B. 1.3克 C. 1.2克 D. 1.1克
难度: 中等查看答案及解析