-
根据下列陈述的知识,类推得出的结论正确的是
A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O
B.SO3通入BaCl2溶液中有白色沉淀生成,则SO2通入BaCl2溶液中也有白色沉淀生成
C.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
D.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
难度: 简单查看答案及解析
-
有机物X能实现下列转化,下列判断错误的是

A.X可以是淀粉或纤维素 B.Y与CH3OCH3是同分异构体
C.Y可以用于消除少量钠屑 D.Y→乙醛属于还原反应
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.Ba(OH)2溶液与过量的NaHCO3溶液混合
Ba2++2OH-+2
BaCO3↓+
+H2O
B.次氯酸钙溶液中通入少量SO2气体:
Ca2++2ClO-+SO2+H2O
CaSO3↓+2HClO
C.金属钾与水反应 2K+2H2O
2K++2OH-+H2↑
D.醋酸与氢氧化钠溶液的反应 H++OH-
H2O
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列叙述正确的是
A.7.8g过氧化钠中含有的离子数为0.4NA
B.将0.1molFeCl3水解制成胶体,所得胶体粒子数为0.1NA
C.等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等
D.常温常压下28 g CO与22.4 L O2所含分子数相等
难度: 简单查看答案及解析
-
下列操作会使H2O的电离平衡向电离方向移动且pH<7的是
A.向水中加少量Na2CO3 B.向水中加少量FeCl3
C.向水中加少量NaHSO4 D.向水中加入少量NaCl
难度: 简单查看答案及解析
-
下列常见有机物中,既能发生取代反应,又能使溴的CCl4溶液褪色的是
A.CH4 B.
C.CH2=CHCH2OH D.CH3COOH
难度: 简单查看答案及解析
-
一定质量的Al、Mg合金与适量的稀硫酸恰好完全反应,将反应后的溶液蒸干,所得固体(不含结晶水)质量比原固体增加了7.2g,则该合金的物质的量可能为
A.0.06mol B.0.05mol C.0.08mol D.0.09mol
难度: 简单查看答案及解析
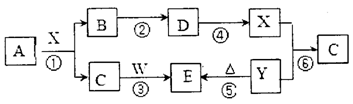
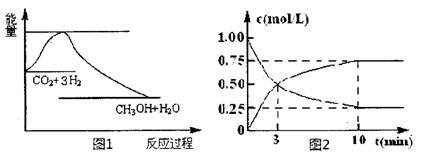

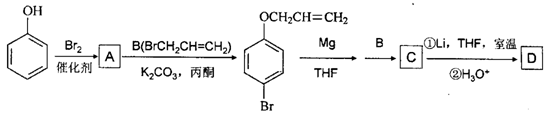
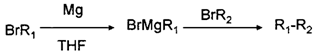 (THF为一种有机溶剂)
(THF为一种有机溶剂)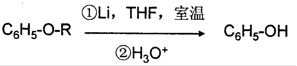
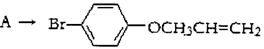 有机反应类型:___________。
有机反应类型:___________。