-
下列有关石油的炼制工艺中,属于获得汽油的主要途径的是
A. 裂化 B. 裂解 C. 常压分馏 D. 减压分馏
难度: 简单查看答案及解析
-
利用海水制取淡水的传统方法是
A. 蒸发 B. 过滤 C. 分液 D. 蒸馏
难度: 简单查看答案及解析
-
在海水提溴过程中,常用热空气或水蒸气将溴吹出,是因为溴单质
A. 化学性质稳定 B. 沸点低,易挥发 C. 不溶于水 D. 易升华
难度: 简单查看答案及解析
-
下列说法错误的是
A. 催化重整是获得芳香烃的主要途径之一
B. 重油的催化裂化主要是为提高轻质油的产量
C. “西气东输”工程中输送的气体主要成分为甲烷
D. 煤经气化和液化等物理变化过程,可变为清洁能源
难度: 中等查看答案及解析
-
化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”.下列观点正确的是
A. 大力提倡开发化石燃料作为能源
B. 研发新型催化剂,提高石油和煤中各组分的燃烧热
C. 化石燃料属于可再生能源,不影响可持续发展
D. 人类应尽可能开发新能源,取代化石能源
难度: 简单查看答案及解析
-
以下措施中不能减少酸雨产生的是
A. 对燃烧煤时产生的尾气进行除硫处理
B. 少用原煤作燃料
C. 燃煤时鼓入足量空气
D. 开发清洁能源
难度: 简单查看答案及解析
-
下列关于燃烧热的说法正确的是
A. 燃烧反应放出的热量就是该反应的燃烧热
B. 1 mol可燃物质发生氧化反应所放出的热量就是燃烧热
C. 1 mol可燃物质完全燃烧生成稳定的化合物时所放出的热量就是燃烧热
D. 在25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量是燃烧热
难度: 简单查看答案及解析
-
煤和石油是两种重要的能源,下列说法正确的是
A. 液化石油气、汽油和石蜡的主要成分都是碳氢化合物
B. 煤经气化和液化两个物理变化过程,可变为清洁能源
C. 石油裂解和油脂皂化都是高分子生成小分子的过程
D. 工业上获得大量的乙烯和丙烯的方法是石油裂化
难度: 中等查看答案及解析
-
化学与人类生活、社会可持续发展密切相关,保护环境问题已经广泛引起人们关注,下列说法不利于环境保护的是
A. 加快化石燃料的开采与使用
B. 推广使用节能环保材料
C. 推广新能源汽车替代燃油汽车
D. 用晶体硅制作太阳能电池将太阳能直接转化为电能
难度: 简单查看答案及解析
-
化学与生产、生活、社会密切相关。下列有关说法错误的是
A. 通过植树造林,可吸收二氧化碳,降低温室效应
B. 应用高纯度单质硅制成光导纤维,提高信息传输速度
C. 化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
D. 开发二氧化碳制成的全降解塑料,缓解日益严重的“白色污染”
难度: 简单查看答案及解析
-
诺贝尔化学奖得主——德国科学家格哈德·埃特尔对一氧化碳在铂表面氧化过程的研究,催生了汽车尾气净化装置。净化装置中催化转化器可将CO、NO、NO2等转化为无害物质。下列有关说法不正确的是
A. 催化转化器中的铂催化剂可加快CO的氧化
B. 铂表面做成蜂窝状更有利于提高催化效果
C. 使用铂催化剂,可以提高CO、NO、NO2的平衡转化率
D. 在铂催化下,NO、NO2可被CO还原成N2
难度: 中等查看答案及解析
-
下列化学工艺流程不可行的是( )
A. FeS2
SO2
H2SO3
H2SO4
B. 石英砂
粗硅
粗SiCl4
 高纯硅
高纯硅C. 提取食盐后的母液
含Br2的溶液
…
粗Br2
 Br2
Br2D.

难度: 困难查看答案及解析
-
“绿色化学”是21世纪化学发展的主导方向。下列不符合“绿色化学” 的是( )
A. 消除硫酸厂尾气中的SO2:SO2+2NH3+H2O===(NH4)2SO3
B. 消除制硝酸工业尾气中的氮氧化物:NO2+NO+2NaOH===2NaNO2+H2O
C. 制CuSO4:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
D. 制CuSO4:2Cu+O2
2CuO,CuO+H2SO4(稀)===CuSO4+H2O
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 多糖、蛋白质都是高分子化合物,一定条件下都能水解
B. 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分开
C. 分馏、干馏都是物理变化,裂化、裂解都是化学变化
D. 尼龙绳、羊绒衫和棉衬衣等生活用品都是由合成纤维制造的
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 乙醇、乙酸、乙酸乙酯都能发生取代反应
B. 等物质的量的乙烯、丙烯分别充分燃烧,所耗氧气的物质的量一样多
C. 芳香族化合物是指含有苯环结构的物质,不一定有芳香气味
D. 石油裂化和裂解的目的均是为了将长链烃转化为短链烃
难度: 简单查看答案及解析
-
下列冶炼金属的方法错误的是
A. 加热分解
制金属Hg B. 高温下用CO还原赤铁矿炼铁
C. 电解
溶液制金属Na D. Fe和
溶液湿法炼铜
难度: 简单查看答案及解析
-
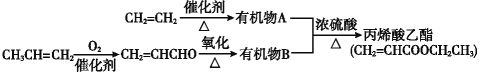
聚丙烯酸酯的结构简式可表示为
 ,由丙烯酸酯加聚得到。下列关于聚丙烯酸酯的说法不正确的是( )
,由丙烯酸酯加聚得到。下列关于聚丙烯酸酯的说法不正确的是( )A. 属于高分子化合物,是混合物
B. 链节为—CH2—CH—
C. 单体为CH2=CH—COOR
D. n为聚合度
难度: 简单查看答案及解析
-
下列热化学方程式中ΔH代表燃烧热的是 ( )
A. CH4(g)+
O2(g)===2H2O(l)+CO(g) ΔH1
B. H2(g)+
O2(g)===H2O(g) ΔH2
C. C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH3
D. 2CO(g)+O2(g)===2CO2(g) ΔH4
难度: 简单查看答案及解析
-
反应2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是
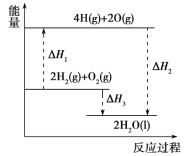
A. ΔH1<0
B. ΔH2为该反应的反应热
C. ΔH3不是H2的燃烧热
D. ΔH2=ΔH1+ΔH3
难度: 中等查看答案及解析
-
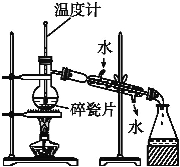
在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是
A.
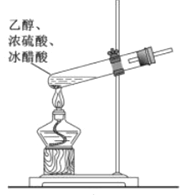 B.
B. 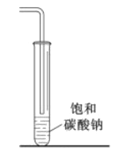 C.
C. 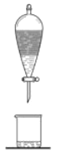 D.
D. 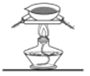
难度: 简单查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(
)是最简单的一种。下列关于该化合物的说法错误的是( )
A. 与环戊烯互为同分异构体 B. 二氯代物超过两种
C. 所有碳原子均处同一平面 D. 生成1 molC5H12至少需要2 molH2
难度: 中等查看答案及解析
-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
A. 常温常压下X的单质为气态
B. Z的氢化物为离子化合物
C. Y和Z形成的化合物的水溶液呈碱性
D. W与Y具有相同的最高化合价
难度: 中等查看答案及解析
-
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8 kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ/mol
C8H18(l)+25/2O2(g)= 8CO2(g)+9H2O(l) △H=-5518 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)
难度: 中等查看答案及解析
-
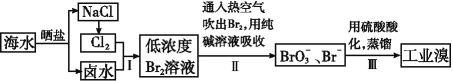
从海带中提取碘的工业生产过程如下:

下列说法不正确的是
A. 为保证I完全被氧化,应通入过量Cl2
B. 试剂R可以为NaOH溶液
C. H2SO4溶液作用之一是使滤液酸化
D. 提纯晶体碘采用升华法
难度: 简单查看答案及解析
-
已知H2的燃烧热为285.8 kJ/mol,CO的燃烧热为282.8 kJ/mol。现有H2和CO组成的混合气体56.0 L(标准状况),充分燃烧后,放出热量710.0 kJ,并生成液态水。下列说法正确的是
A. CO燃烧的热化学方程式为2CO(g)+O2(g)
2CO2(g) ΔH=+282.8 kJ/mol
B. H2燃烧的热化学方程式为2H2(g)+O2(g)
2H2O(g) ΔH=−571.6 kJ/mol
C. 燃烧前的混合气体中,H2的体积分数为40%
D. 混合气体燃烧后与足量的过氧化钠反应,转移电子2 mol
难度: 中等查看答案及解析