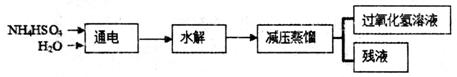
-
2011年3月11日,日本东部发生9.0级特大地震,引发海啸、福岛核泄漏、环境污染等严重 问题。与此次危机有关的化学问题中,下列说法正确的是
A.碘虽然有助于防止核辐射,但服用过量,容易引发甲状腺疾病,因此不能盲目服用
B.福岛核电站泄漏的铯-137的放射性是化学性质
C.福岛核电站的燃料之一是钚(
),Pu在元索周期表中位于第六周期
D.在核辐射中对人体造成危害的碘是
,它是碘的一种放射性同位素,其质子数为78
难度: 中等查看答案及解析
-
下列排列的顺序正确的是
A.热稳定性: H2O>HF>H2S B.熔点:Al>K>Na
C.碱性:Al(OH)3>Mg(OH)2>LiOH D.结合质子能力:CO32->CH3COO﹣>SO42-
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.漂白粉溶液中通入过量二氧化碳气体:2ClO﹣ + CO2 + H2O=2HCIO + CO32-
B.用食醋除去水壶内的水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C.NH4HCO3溶液中加入过量NaOH溶液:NH4++OH﹣=NH3·H2O
D.在NaHCO3溶液中加入少量石灰水:2HCO3﹣+2OH﹣+Ca2+=CaCO3↓+ CO32-+2H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.0.1mol/L的氨水和0.1mol/L的硝酸等体积混合,充分反应后所得溶液中:
c(NO3﹣)>c(NH4+)>c(OH﹣)>c(H+)
B.0.1mol/L的醋酸溶液中:c(H+)=c(CH3COO﹣)
C.将氨气通入一定量硫酸溶液中,充分反应后溶液pH=7则;c(NH4+)>c(SO42-)
D.0.1mol/L的硫化钠溶液中:c (Na+)=2c(S2-)+c(HS-)+c(H2S)
难度: 中等查看答案及解析
-
下列关于物质分离和提纯的方法正确的是
A.用过滤法除去Fe(OH)3胶体中的氯离子
B.苯中含有少量苯酚,加入溴水后过滤
C.FeCl2溶液中有少量FeCl3,加入过量铁粉,充分反应后过滤
D.乙酸乙酯中混有少量乙酸,加入NaOH溶液后萃取
难度: 中等查看答案及解析
-
中草药秦皮中含有的七叶树内酯(
),它具有抗菌作用。关于七叶树内酯的说法正确的是
A.七叶树内酯的官能团只有l种
B.1mol七叶树内酯与足量的溴水和氢氧化钠完全反应消耗3 mol Br2和4 mol NaOH
C.七叶树内酯中所有的原子一定都在同一平面 ‘
D.七叶树内酯的分子式为C9H5O4
难度: 中等查看答案及解析
-
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
。下列说法正确的是
A.放电时正极反应为:
B.充电时阴极反应为:
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
难度: 中等查看答案及解析
-
相同温度下,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:
2XY2(g)+Y2(g)
2XY3(g)
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器
起始时各物质物质的/mol
达平衡时体系能量的变化
编号
XY2
Y2
XY3
①
2
1
0
放热0.25QkJ
②
1.2
0.6
0.8
下列叙述不正确的是
A.达到平衡时,①和②两容器中气体的平均相对分子质量相同
B.容器②中反应达到平衡时放出的热量为0.15 Q kJ
C.达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol·L-1
D.若容器①的其他条件不变,只增加1mol稀有气体,则达到平衡时放出的热量等于0.25 Q kJ
难度: 中等查看答案及解析
-
已知X、Y、Z为三种由短周期元素构成的10个电子的粒子,其结构特点如下:
粒子代码
X
Y
Z
原子核数
单核
两核
四核
粒子的电荷数
一个单位正电荷
一个单位负电荷
0
物质A由X、Y构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①~⑤都是用于工业生产的反应,反应⑥中个别产物在图中略去。请填写下列空白:
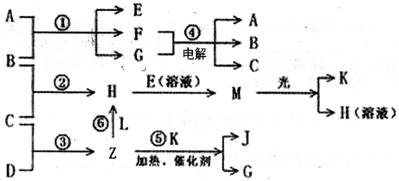
(1)Y的化学式是_______,Z分子的空间构型为_______,A的电子式为_______。
(2)写出下列反应的离子反应方程式:
H+E(溶液)→M________________________________________________________
F+G→A+B+C_____________________________________________
(3)L是由3种元素构成的分子,能与Z以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,写出L的结构式:____________。
(4)常温下,实验室模拟工业反应④的过程如右图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=______。(假设气体完全逸出,溶液体积不变)

难度: 中等查看答案及解析