-
“促进低碳经济” 是世界环境日的主题,《联合国气候变化框架公约》第15次缔约方会议也商讨了2012年至2020年的全球减排协议。下列行为中不符合“促进低碳经济”宗旨的是
A.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
B.将煤进行气化处理,提高煤的综合利用效率
C.开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
难度: 中等查看答案及解析
-
据科学家预测,月球的土壤中吸附着数百万吨的23He,每百吨23He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以24He的形式存在.下列说法中正确的是
A.24He原子核内含有4个质子
B.24He和23He互为同位素
C.23He原子核内含有3个中子
D.24He的最外层电子数为2,故24He具有较强的金属性
难度: 简单查看答案及解析
-
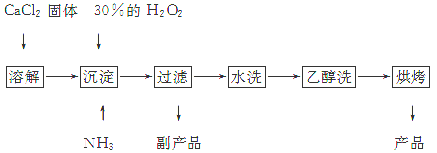
“10%的氨水”的正确解释是
A .100g氨水中含10gNH3•H2O B.10gNH3溶于水形成100g溶液
C.100g氨水中含10gNH3 D.10gNH3溶于100gH2O形成的溶液
难度: 中等查看答案及解析
-
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
L气体,则被还原的H2SO4的质量是
A.
mol B.
mol C.
g D.
g
难度: 中等查看答案及解析
-
核电站遭破坏,会造成放射性物质53131I和55137Cs向外界泄漏.下列有关说法错误的是
A.每个53131Cs含有78个中子 B.CsOH的碱性比KOH的强
C.HI的还原性比HF的强 D.KIO3是碘的最高价含氧酸的盐
难度: 中等查看答案及解析
-
将1.6gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体0.896L(标准状况),则反应中消耗HNO3的物质的量为
A.0.09mol B.1mol C.1.05mol D.0.11mol
难度: 中等查看答案及解析
-
根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是
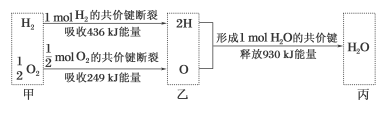
A.H2O分解为H2与O2时放出热量
B.1molH2与0.5molO2完全反应生成1mol H2O时放出热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA
B.4℃时,18g 2H216O中含有共用电子对数为2NA
C.用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.1 mol N5+含有的电子数为34NA
难度: 中等查看答案及解析
-
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如右图:

下列判断错误的是
A.G是最活泼的非金属单质 B.L能使紫色石蕊试液变红色
C.E能使紫色石蕊试液变蓝色 D.M是化学性质很活泼的单质
难度: 中等查看答案及解析
-
能说明元素X的气态原子得电子能力比元素Y的气态原子得电子能力强的事实是
A.元素周期表中X位于Y的上一周期
B.将H2X、HY分别加热至500℃,只有HY发生分解
C.X的含氧酸的酸性强于Y的含氧酸的酸性
D.X与Y同主族,相同温度时,二者的单质与铜反应分别生成Cu2X CuY
难度: 中等查看答案及解析
-
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A顺序依次减小,B和E是同族,则下列推断中正确的是
A.A、B、E一定处于1、2、3三个不同周期
B.A、D不可能在同一主族
C.C的最高氧化物的水化物不可能显碱性
D.C和D的单质不可能化合成1∶1型离子化合物
难度: 中等查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.用渗析法除去淀粉中混有的NaCl
D.已知I
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
难度: 中等查看答案及解析
-
按如图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示
①c(Ag+) ②c(NO3﹣) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
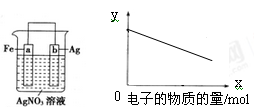
A.①③ B.②④ C.①③⑤ D.②④⑥
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用.下列说法不正确的是
A.明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.当光束通过鸡蛋清水溶液时,能观察到丁达尔效应
C.Li是最轻的金属,也是活动性较强的金属,是制造电池的理想物质
D.水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的
难度: 中等查看答案及解析
-
镁锰干电池的电化学反应式为:Mg+2MnO2+H2O = Mg(OH) 2+Mn2O3。下列说法不正确的是
A.反应后正极和负极附近溶液的pH均升高
B.可以选择碱性溶液作为电解质
C.镁为负极,发生氧化反应
D.正极的电极反应为:2MnO2+H2O+2e- = Mn2O3+2OH-
难度: 中等查看答案及解析
-
2C + O2 = 2CO,2CO + O2 = 2CO2 都是放热反应。下列说法不正确的是
A.12gC与16gO2所具有的总能量一定高于28gCO所具有的能量
B.56gCO所具有的能量大于88gCO2所具有的总能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多
难度: 中等查看答案及解析
-
一定温度下,反应N2+O2
2NO在密闭容器中进行,下列措施不能改变化学反应速率的是
A.缩小体积使压强增大 B.恒容,充入N2
C.恒压,充入He D.恒容,充入He
难度: 中等查看答案及解析
-
下列关于Cs描述中,错误的是
A.CsOH是一种既可与强酸又可与强碱反应的两性氢氧化物
B.Cs在空气中燃烧可生成Cs2O和Cs2O2
C.Cs与水反应,能发生爆炸,并放出H2
D.CsOH很稳定,加热不易分解
难度: 中等查看答案及解析
-
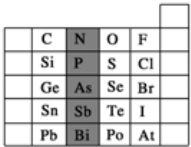
元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
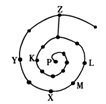
A.L、M、X三元素位于同一族
B.K、Z两元素的氢化物的水溶液都显酸性
C.Y元素对应的氢化物比K元素对应的氢化物沸点低
D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
难度: 中等查看答案及解析
-
铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示。则下列分析正确的是

A.图1中,A到B的过程中有0.005 mol电子发生了转移
B.图1整个过程中共生成0.18 g水
C.图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D.图1中A和B化学式分别为Cu2O和CuO
难度: 中等查看答案及解析