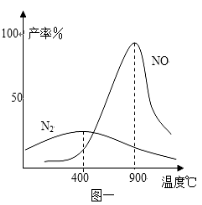
-
化学知识与日常生活密切相关。下列说法不正确的是
A.镀锡铁板比镀锌铁板更耐腐蚀
B.水常温下呈液态,冰浮在水面上,均与氢键有关
C.用纯碱溶液清洗油污时,加热可增强其去污能力
D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
难度: 简单查看答案及解析
-
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.将锌粒投入CuSO4溶液
C.CO2通过Na2O2粉末 D.将铜片投入FeCl3溶液
难度: 简单查看答案及解析
-
下述实验不能达到预期实验目的的是
序号
实验内容
实验目的
A
室温下,使用pH计分别测定浓度均为0.1mol/L NaClO溶液CH3COONa
比较HClO和CH3COOH的酸性强弱
B
室温下,向两支装有同体积同浓度H2O2溶液的试管中,分别加入3滴同浓度的CuSO4、FeSO4溶液,观察产生气泡的快慢。
比较CuSO4、FeSO4作为催化剂对H2O2分解速率的影响
C
向0.1mol/LAgNO3溶液中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成,再向其中滴入0.1mol/L KI溶液,观察沉淀颜色变化。
比较AgCl与AgI溶解度的相对大小
D
向含有少量FeCl3的MgCl2酸性溶液中加入Mg(OH)2,加热并搅拌,过滤。
除去MgCl2酸性溶液含有的少量FeCl3
难度: 中等查看答案及解析
-
Cl2O与OF2互为等电子体,均能与水反应(与水解反应原理类似),Cl2O与水反应的化学方程式为:Cl2O+H2O=2HClO。下列说法正确的是
A.Cl2O与水的反应属于氧化还原反应
B.OF2、Cl2O分子的立体构型均为直线形
C.Cl2O分子中的共用电子对偏向Cl ,OF2分子中的共用电子对偏向F
D.OF2与水反应的化学方程式为:OF2 + H2O = 2HF + O2
难度: 中等查看答案及解析
-
已知:① C(s)+O2(g)=CO2(g) △H1; ② CO2(g)+C(s)=2CO(g) △H2;
③ 2CO(g)+O2(g)=2CO2(g) △H3; ④ 4Fe(s)+3O2(g)=2Fe2O3(s) △H4;
⑤3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列判断正确的是
A.上述反应中△H1~ H5均大于0 B.△H1=△H2- △H3
C.3△H3=△H4 + 2 △H5 D.△H5=3△H1+△H4
难度: 中等查看答案及解析
-
25℃时,向20 mL 0.2 mol/L H2A(某二元弱酸)溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法中正确的是
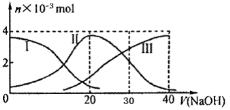
A.当V(NaOH)=20mL时,所得溶液中:c(OH-)> c(H+)
B.当V(NaOH)=30mL时,所得溶液中:2c(H+) + c(HA-) + 3c(H2A) = c(A2-) + 2 c(OH-)
C.当V(NaOH)=40mL时,所得溶液中:c(Na+)> c(A2-) >c(H+)> c(HA-) >c(OH-)
D.在NaHA溶液中:c(OH-)+2c(A2-) = c(H+)+2c(H2A)
难度: 困难查看答案及解析
-
在温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
温度
时间/min
物质的量
0
10
20
40
50
T1
n(CH4)/mol
0.50
0.35
0.25
0.10
0.10
T2
n(CH4)/mol
0.50
0.30
0.18
x
0.15
下列说法正确的是
A.T1>T2,且a>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),反应开始时,ν(正)>ν(逆)
难度: 中等查看答案及解析