-
以下表示锂离子结构的轨道表示式是( )
A. Li+ B.
C. 1s2 D.
难度: 简单查看答案及解析
-
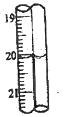
放射性同位素 131 I ,其左上角数字“131”表示( )
A. 质量数 B. 中子数 C. 质子数 D. 电子数
难度: 中等查看答案及解析
-
下列物质的用途中,利用物质氧化性的是
A.氧化铝做耐火材料 B.K、Na合金作原子反应堆导热剂
C.焦炭用于炼铁工业 D.次氯酸消毒餐具
难度: 中等查看答案及解析
-
下列物质中,化学式能准确表示该物质分子组成的是( )
A. SiO2 B. MgO C. Ar D. C
难度: 简单查看答案及解析
-
下列有关晶体的说法正确的是( )
A. 分子晶体中一定不含离子键 B. 分子晶体中一定含有共价键
C. 离子晶体中一定只含离子键 D. 离子晶体的熔点一定比共价化合物高
难度: 简单查看答案及解析
-
“结构决定性质”,有关物质结构的下列说法中正确的是( )
A. 碘熔化时破坏了化学键
B. 共价化合物不一定是电解质
C. 干冰晶体内存在非极性键与范德华力
D. 液态氟化氢中存在氢键,故氟化氢比氯化氢更稳定
难度: 简单查看答案及解析
-
下列叙述中,能证明某物质是弱电解质的是( )
A. 熔化时不导电 B. 水溶液的导电能力很差
C. 属于共价化合物 D. 溶液中已电离的离子和未电离的分子共存
难度: 简单查看答案及解析
-
已知某元素一种同位素的原子的质子数为 m,中子数为 n,则下列说法错误的是( )
A. 据此可确定该原子的质量数 B. 据此可确定该元素的相对原子质量
C. 据此可确定该原子的核外电子数 D. 据此可确定该元素在周期表中的位置
难度: 中等查看答案及解析
-
下列变化不能说明发生了化学变化的是( )
A. 变化时有电子的得失或共用电子对的形成
B. 变化时释放出能量
C. 变化过程中有旧化学键的断裂和新化学键形成
D. 变化前后原子的种类和数目没有改变,分子种类增加了
难度: 简单查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是( )
A. CH3COOH B. Cl2 C. NH4HCO3 D. SO2
难度: 简单查看答案及解析
-
下列图中,能正确表示 N2 3H2 2NH3 Q 过程的能量变化的是( )
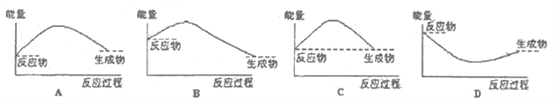
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子 NF3 和一种铵盐 N。下列有关说法 错误的是( )
A. 该反应的化学方程式为 4NH3 3F2 NF3 3NH4F
B. NF3 是非极性分子
C. NF3 既是氧化产物,又是还原产物
D. N 中既含有离子键,又含有共价键
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 原子晶体中的相邻原子都以共价键相结合
B. 金属晶体的熔点都比分子晶体的熔点高
C. HF、HCl、HBr、HI 的稳定性依次增强
D. BaO2 固体中的阴离子和阳离子个数比为 2:1
难度: 简单查看答案及解析
-
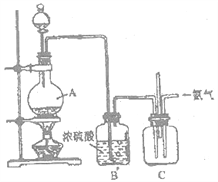
用石墨电极电解 CuCl2 溶液(装置如右图),下列说法错误的是( )

A. A 是阴极,电解时析出铜
B. B 是阳极,电解时有氯气放出
C. 阳极上发生的反应: Cu22e- Cu
D. A 发生还原反应
难度: 中等查看答案及解析
-
结合右图判断,下列叙述正确的是( )
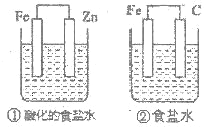
A. ①中铁的腐蚀被加速
B. ①和②中负极反应均是 Fe 2e- Fe2
C. ②中碳棒上反应是 O2+2H2O+4e-→4OH-
D. ①为钢铁的析氢腐蚀,②为钢铁的吸氧腐蚀
难度: 中等查看答案及解析
-
下列叙述中能肯定判断某化学平衡发生移动的是( )
A. 混合物中各组分的浓度改变 B. 混合体系中气体密度发生变化
C. 正、逆反应速率改变 D. 反应物的转化率改变
难度: 中等查看答案及解析
-
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
难度: 简单查看答案及解析
-
反应 X(g)+ Y(g)
2Z(g)(正反应放热),在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示。若使曲线a变为曲线b,可采取的措施是:( )
A. 加入催化剂 B. 降低温度 C. 增大压强 D. 增大Y的浓度
难度: 中等查看答案及解析
-
下列事实不能用勒沙特列原理解释的是( )
A. 合成氨工业选择的反应条件不是室温,是 500℃左右
B. 用浓磷酸与 KBr 反应制备 HBr 气体
C. 实验室常用排饱和食盐水的方法收集氯气
D. 硫酸工业中,使用过量的空气以提高二氧化硫的利用率
难度: 中等查看答案及解析
-
在恒容密闭容器中可逆反应 4NH3 (g) 5O2 (g)
4NO(g) 6H2O(g) ,下列叙述正确的是
( )
A. 达到平衡时,4V 正(O2)=5V 逆(NO)
B. 若单位时间内生成 x mol NO 的同时,消耗 x mol NH3,则反应达到平衡状态
C. 达到平衡时,若增大容器的体积,V 正减少 V 逆反应速率增大
D. 容器中混合气体的密度保持不变,则反应达到平衡状态
难度: 简单查看答案及解析
-
NA 表示阿伏伽德罗常数,下列叙述正确的是( )
A. 125g CuSO4 5H2O 晶体中含有 Cu离子数一定小于 0.5NA
B. 常温下,pH=3 的醋酸溶液中,醋酸分子的数目一定大于103 NA
C. 由 S6、S7、S8 组成的硫蒸气 6.4g,其中所含硫原子数一定为 0.2NA
D. 3.6g C 与 3.36L O2 一定条件下恰好完全反应,生成 CO 分子数一定为 0.3NA
难度: 中等查看答案及解析
-
向1mol炽热的Cu2S通入足量的水蒸气,充分反应后生成2mol H2,则Cu2S应转化为
A. Cu和SO2 B. Cu和S C. CuO和SO2 D. Cu2O和S
难度: 简单查看答案及解析