-
学习化学过程中需要经常做实验。下列实验操作正确的是

难度: 简单查看答案及解析
-
①烧杯②坩埚③蒸发皿④试管⑤蒸馏烧瓶⑥锥形瓶⑦燃烧匙
A. ①⑤⑥ B. ③⑥⑦ C. ①⑤ D. ⑤⑥⑦
难度: 简单查看答案及解析
-
现有三组实验:①除去混在植物油中的水②回收碘的CCl4溶液中的CCl4③用食用酒精浸泡中草药提取其中的有效成分。分离以上混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
难度: 中等查看答案及解析
-
Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质归为一类,下列哪些物质还可以和它们归为一类
A.75%的酒精溶液 B.硝酸钠 C.Fe(OH)3胶体 D.豆浆
难度: 中等查看答案及解析
-
下图所表示的一些物质或概念间的从属关系不正确的是
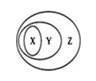
X
Y
Z
A
干冰
氧化物
纯净物
B
冰水混合物
电解质
化合物
C
淀粉溶液
胶体
分散系
D
置换反应
氧化还原反应
离子反应
难度: 中等查看答案及解析
-
当光束通过下列分散系:①有尘埃的空气 ②稀硫酸 ③蒸馏水 ④墨水,能观察到有丁达尔现象的是
A.①④ B.②③ C.①② D.②④
难度: 中等查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:其中正确的是:
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④①③⑤
难度: 中等查看答案及解析
-
在同温同压下,A容器的H2和B容器的NH3,若所含氢原子数目之比为2:3,则这两个容器的体积比是
A.1:1 B.2:3 C.3:2 D.1:3
难度: 中等查看答案及解析
-
在体积相同的三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度与密度都相同时,这三种气体的分子数(N)从大到小的顺序是
A.N(Ne)>N (H2)>N (O2) B.N (O2)>N (Ne)>N (H2)
C.N (H2)>N (O2)>N (Ne) D.N (H2)>N (Ne)>N (O2)
难度: 困难查看答案及解析
-
在标准状况下,如果2.8L氧气含有n个氧原子,则阿伏伽德罗常数可表示为
A.n/8mol-1 B.n/16 mol-1 C.8n mol-1 D.4n mol-1
难度: 中等查看答案及解析
-
在标准状况下:①6.72L CH4②3.01×1023个HCL分子③13.6gH2S④0.2molNH3,下列对这四种气体的关系从大到小表达正确的是
A.体积②>③>④>① B.密度②>③>①>④
C.质量②>③>①>④ D.氢原子个数②>④>③>①
难度: 中等查看答案及解析
-
下列溶液中c(Cl-)与50mL1mol/LAlCl3溶液中c(Cl-)相等的是
A.150mL 1mol/L的NaCl溶液 B.75mL 2mol/L的NH4Cl溶液
C.150mL 2mol/L的KCl溶液 D.75mL 1mol/L的FeCl3溶液
难度: 中等查看答案及解析
-
将12mol/L的盐酸(p=1.19g/㎝3)50mL稀释成6mol/L的盐酸(p=1.10g/㎝3),需加水的体积为
A.50mL B.50.5mL C.55mL D.59.5mL
难度: 中等查看答案及解析
-
在强酸或强碱溶液中都能大量共存的是
①K+、Cl-、NO3-、S2-
②K+、Fe2+、I-、SO42-
③Na+、SO42-、Cl-、NO3-
④Na+、Ca2+、Cl-、HCO3-
⑤K+、Ba2+、NO3-、Cl-
A.①③ B.③⑤ C.③④ D.②⑤
难度: 中等查看答案及解析
-
某溶液中只含有Na+、Al3+、Cl- 、SO42-四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和SO42-的离子个数比为
A.1:2 B.1:4 C.3:4 D.3:2
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O
B.锌与盐酸的反应:Zn+2H++2Cl-=Zn2++2Cl-+H2↑
C.石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
D.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-
NH3↑+H2O
难度: 中等查看答案及解析
-
以下说法正确的是
A.有单质参加或生成的反应一定是氧化还原反应
B.在氧化还原反应中,失去电子的元素化合价降低
C.物质中某元素失去电子,则此物质是氧化剂
D.还原剂中必定有一种元素被氧化
难度: 中等查看答案及解析
-
用0.4molNa2SO3恰好被0.1mol氧化剂X2O72-氧化生成Na2SO4,则元素X在还原产物中的化合价是
A.+6 B.+3 C.+2 D.0
难度: 中等查看答案及解析
-
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F。在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3(NO遇氧气生成红棕色的NO2)。下列说法正确的是
A.在NF3与H2O的反应中,H2O做还原剂
B.制取NF3的反应中,氧化剂与还原剂的物质的量之比为3:1
C.若在制取NF3的反应中有0.5mol NH3参加反应,转移电子的物质的量为3mol
D.NF3在潮湿的空气中一旦泄漏,不易被发现
难度: 困难查看答案及解析
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,工业上常通过以下两步反应制备K2FeO4:
①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,
②Na2FeO4+2KOH=K2FeO4+2NaOH。
下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中Na2FeO4是还原产物
C.Na2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6mol
难度: 困难查看答案及解析