-
为纪念编制了第一个元素周期表的俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔。该元素最稳定的一种原子可以表示为
,该原子所含中子的数目为
A. 56 B. 157 C. 258 D. 101
难度: 简单查看答案及解析
-
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A. 若质量相等,则质子数相等 B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积相等 D. 若体积相等,则密度相等
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. HCl的电子式
B. Cl-的结构示意图
C. CO2的电子式
D. 质量数为37的氯原子
难度: 简单查看答案及解析
-
下列说法正确的是
A. 14CO2的摩尔质量为46g
B. 2.0g D2O中含有6.02×1023个中子
C. 标准状况下,2.24L CCl4所含的原子数为0.5NA
D. 50mL 1mol/L BaCl2溶液中,Ba2+和Cl-物质的量之和是0.1mol
难度: 简单查看答案及解析
-
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A. X的原子半径一定大于Y的原子半径
B. X与Y的简单离子不可能具有相同的电子层结构
C. X2Y可能是离子化合物,也可能是共价化合物
D. 两元素形成的化合物中,原子个数比不可能为1︰1
难度: 简单查看答案及解析
-
能实现下列物质间直接转化的元素是
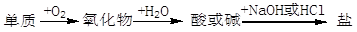
A.硫 B.铁 C.硅 D.铜
难度: 简单查看答案及解析
-
下列各组中的性质比较,正确的是
A. 酸性HClO4>HBrO4>HIO4 B. 碱性NaOH>Mg(OH)2>Ca(OH)2
C. 稳定性:HI>H2S> HCl D. 氧化性:Na+>Mg2+>Al3+
难度: 简单查看答案及解析
-
下列物质中,含有极性共价键的是
A. 单质碘 B. 氯化镁 C. 过氧化钠 D. 水
难度: 简单查看答案及解析
-
下列微粒中,跟NH4+的电子总数和质子总数相同的是
A. Ne B. F C. H3O+ D. CH4
难度: 简单查看答案及解析
-
下列说法中,不正确的是
A. 若反应时形成新化学键释放的能量大于断裂旧化学键所吸收的能量,则该化学反应是释放能量的反应
B. 若反应物的总能量大于生成物的总能量,则该化学反应为释放能量的反应
C. 化学反应中能量变化的大小与反应物的质量多少无关
D. 化学反应必然伴随着能量的变化
难度: 简单查看答案及解析
-
硼有两种天然同位素510B、511B,硼元素的相对原子质量10.80,则对硼元素中510B原子百分含量的判断正确的是
A.20% B.略大于20% C.略小于20% D.80%
难度: 简单查看答案及解析
-
下列离子方程式表示氧化还原反应的是
A. HCO3-+OH-=H2O+CO32- B. H3PO4+3OH-=PO43-+3H2O
C. Fe(OH)3+3H+=Fe3++3H2O D. 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
难度: 简单查看答案及解析
-
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是
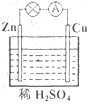
①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn -2e-=Zn2+ ④Cu2+在溶液中由Cu棒向Zn棒迁移
A. ①② B. ①②③ C. ②③④ D. ①②③④
难度: 简单查看答案及解析
-
有a、b、c、d四种金属,将a与b用导线连结起来浸入某电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
A. d、a、b、c B. b、a、d、c C. d、b、a、c D. d、c、a、b
难度: 简单查看答案及解析
-
直接提供电能的反应一般是放热反应,下列反应中能提供电能的是
A. Ba(OH)2·8H2O与NH4Cl反应 B. 氢氧化钠与稀盐酸反应
C. 灼热的炭与CO2反应 D. H2与Cl2燃烧反应
难度: 简单查看答案及解析
-
C、CO、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、110.5 kJ、890.3 kJ、1366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是
A. C B. CO C. CH4 D. C2H5OH
难度: 简单查看答案及解析
-
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是A.①③ B. ③④ C. ①② D. ①③④
难度: 简单查看答案及解析
-
下列说法正确的是
A. 加大煤燃烧时与空气的接触面积,是为了获得更多的能量
B. 钢铁易生锈被腐蚀,而铝、银等金属不容易被腐蚀,是因为铁的活泼性强
C. 氢氧燃料电池把氢气和氧气燃烧放出的热能转化为电能
D. 在实验室使用大理石与稀盐酸反应制取CO2,是为了控制CO2生成的速率
难度: 简单查看答案及解析
-
某课外实验小组设计的下列实验不合理的是
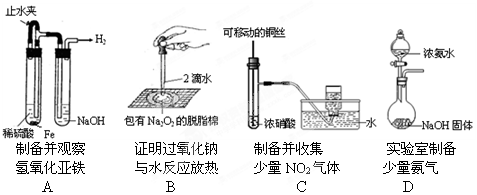
难度: 简单查看答案及解析
-
一定条件下,体积为10L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
A. 反应进行30s时,正反应速率等于逆反应速率
B. 反应进行80s时,逆反应速率大于正反应速率
C. 以Y浓度变化表示的反应速率为0.001mol/(L·s)
D. 反应进行80s时,X物质的量浓度为0.04mol/L
难度: 简单查看答案及解析