-
下列关于常见有机物的说法不正确的是( )
A.乙烯和苯都能与溴水反应
B.乙酸和油脂都能与氢氧化钠溶液反应
C.糖类和蛋白质都是人体重要的营养物质
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别难度: 中等查看答案及解析
-
下列分离方法不合理的是( )
A.用分馏的方法,可从石油中得到汽油
B.提取溴水中的溴,可用加入乙醇萃取的方法
C.只含有泥沙的粗盐,可通过溶解、过滤、结晶的方法提纯
D.除FeCl2溶液中的少量FeCl3,可用加入足量铁屑过滤的方法难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是( )
A.人造纤维、合成纤维和光导纤维都是有机高分子化合物
B.加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性
C.棉、麻、丝、毛燃烧后都只生成CO2和H2O
D.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝难度: 中等查看答案及解析
-
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
A.这四种离子的电子层结构相同,因而离子的性质也就相同
B.原子序数:b>a>c>d
C.最高价氧化物对应水化物的碱性:B>A
D.气态氢化物的稳定性:D>C难度: 中等查看答案及解析
-
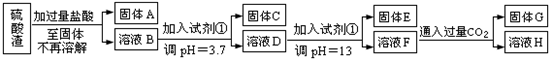
有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:
①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生.
下列推断不正确的是( )
A.肯定没有NH4+、HCO3-、MnO4-
B.可能有K+、Cl-
C.肯定有Al3+、Mg2+、SO42-
D.可能有K+、Cl-、HCO3-难度: 中等查看答案及解析
-
下列反应中,相关示意图象错误的是( )




将二氧化硫逐渐通入到一定量氯水中 将氨水逐渐滴入到一定量氯化铝溶液中 将铜粉逐渐加入到一定是浓硝酸中 将铁粉逐渐加入到一定量氯化铁溶液中 A B C D
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在一定条件下,固定容积的密闭容器中的反应:2NO2(g)⇌O2(g)+2NO(g);△H>0,达到平衡时,若改变其中一个条件X,Y随X的变化符合图中曲线的是( )
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量难度: 中等查看答案及解析