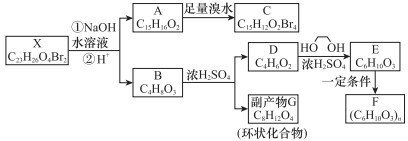
-
下列说法不正确 的是( )
A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
B.蔗糖、淀粉、油脂及其水解产物均为非电解质
C.通过红外光谱分析可以区分乙醇与乙酸乙酯
D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全
B.在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在
C.在“硫酸亚铁铵的制备”实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
D.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理难度: 中等查看答案及解析
-
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2难度: 中等查看答案及解析
-
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( )
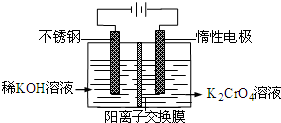
A.在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+⇌Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-难度: 中等查看答案及解析
-
下列说法正确的是( )
A.按系统命名法,化合物的名称为2,6-二甲基-5-乙基庚烷
B.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽
C.化合物是苯的同系物
D.三硝酸甘油酯的分子式为C3H5N3O9难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③难度: 中等查看答案及解析
-
水溶液X中只可能溶有K+、Mg2+、Al3+、
、
、
、
、
中的若干种离子.某同学对该溶液进行了如图所示实验:

下列判断正确的是( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、和
一定存在于溶液X中
D.和
一定不存在于溶液X中
难度: 中等查看答案及解析
-
可正确表示原子轨道的是( )
A.2s
B.2d
C.3pz
D.3f难度: 中等查看答案及解析
-
下列物质变化,只与范德华力有关的是( )
A.干冰熔化
B.乙酸汽化
C.乙醇与丙酮混溶
D.溶于水
E.碘溶于四氯化碳
F.石英熔融难度: 中等查看答案及解析
-
下列物质中,只含有极性键的分子是( ),既含离子键又含共价键的化合物是( ),只存在σ键的分子是( ),同时存在σ键和π键的分子是( )
A.N2
B.CO2
C.CH2Cl2
D.C2H4
E.C2H6
F.CaCl2
G.NH4Cl
难度: 中等查看答案及解析