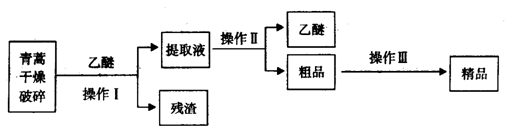
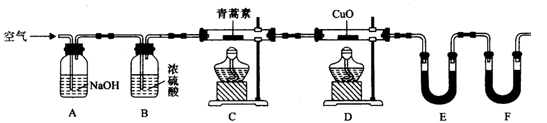
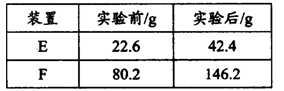
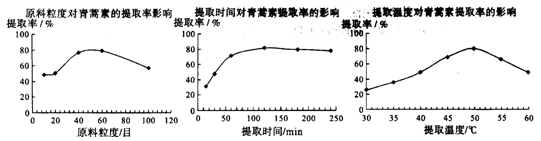
-
化学与生活、社会发展息息相关,下列有关说法不正确的是
A.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
B.某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. 制造新版人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
难度: 简单查看答案及解析
-
天然化合物M(假蜜环菌素)的结构简式如图所式。对M的结构与性质叙述错误的是

A.M的分子式为C12H10O5
B.M能发生取代反应、加成反应、氧化反应、还原反应
C.M中碳原子之间全部以C—C键或C=C键相互结合
D.M的同分异构体最多含有2个与乙酸相同的官能团
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.60 g丙醇中存在的共价键总数为10 NA
B.50 mL 12 mol·L -1盐酸与足量MnO2共热,转移的电子数为0.3NA
C.5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数为3.75NA
D.235 g核素
发生裂变反应:
净产生的中子(
)数为10 NA
难度: 中等查看答案及解析
-
下列操作或装置能达到实验目的的是

A. 用图1除去氯气中的HCl气体
B. 用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
C. 用图3所示装置可以萃取,充分振荡后静置,下层溶液为橙红色,上层为无色
D. 根据图4的溶解度变化可知,在较低温度下容易分离MgSO4·7H2O和CaSO4·2H2O
难度: 中等查看答案及解析
-
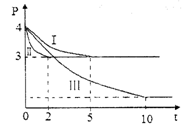
25℃时,将浓度均为0.1mol·L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是
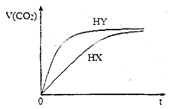
A.相同浓度的HX和HY溶液中水的电离程度:HX﹥HY
B.相同体积相同浓度的HX和HY溶液中阴离子数目前者大于后者
C.向10 mL 0.1 mol·L -1的Na2CO3溶液中缓慢滴加10 mL 0.1 mol·L -1的HY,混合后的离子浓度大小关系:c(Na+)﹥c(Y-)﹥c(HCO3-)﹥c(OH-)﹥c(H+)
D.将等体积等浓度的HX和HY溶液分别用相同浓度的氢氧化钠溶液滴定,至中性时,消耗的氢氧化钠溶液体积前者大于后者
难度: 困难查看答案及解析
-
如图所示,甲装置可直接除去城市废水中的尿素,既能产生净化的水,又能发电。乙装置可用于人工肾脏间接电化学方法除去代谢产物中的尿素的工作原理。下列关于描述正确的是
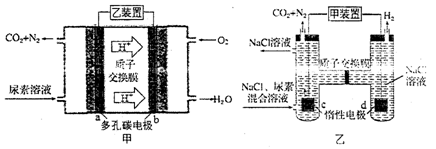
A.甲乙装置连接是a接c、b接d
B.甲装置工作时H+移向负极
C.乙装置阴极室溶液的pH与电解前相比将升高
D.a和c电极都发生CO(NH2)2-6e-+H2O==N2↑+CO2↑+6H+
难度: 困难查看答案及解析