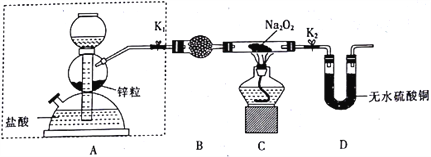
-
化学与生产、生活、社会密切相关,下列有关说法中正确的是
A. 地沟油经过加工处理后可用来制生物柴油和肥皂
B. 用填埋法处理未经分类的生活垃圾
C. 大量使用薪柴为燃料,践行低碳生活
D. 含PM2.5(直径小于或等于2.5微米的颗粒物)的空气能产生丁达尔效应
难度: 中等查看答案及解析
-
2017年5月9日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如
、
等。下列说法正确的是
A.
和
的化学性质不同 B.
和
质子数相同,中子数不同
C. Ts位于周期表的第六周期ⅦA族 D. 元素Ts的相对原子质量为293.5
难度: 困难查看答案及解析
-
下列有关物质的分类中正确的是
选项
A
B
C
D
名称




分类
高分子化合物
弱电解质
纯净物
混合物
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 由水电离的c( H+) =10-13 mol·L-l的溶液中:Na+、NH4+、C1-、HCO3-
B. 滴人酚酞显红色的溶液中:Na+、Mg2+、SO42-、AlO2-
C. 能使红色石蕊试纸变蓝的溶液中:K+、Ba2+、NO3-、CH3COO-
D. pH=4的溶液中:Na+、Fe3+、SCN-、Br-
难度: 困难查看答案及解析
-
《余冬录》中对胡粉[主要成分为2PbCO3·Pb(OH)2]的制法有如下描述:“嵩阳产铅,居民多造胡粉。其法:铅块悬酒缸内,封闭四十九日,开之则化为粉矣。化不白者,炒为黄丹。黄丹滓为密陀僧。”其中黄丹的主要成分为Pb3O4,密陀僧的主要成分为PbO。下列说法错误的是
A. 胡粉难溶于水
B. 胡粉和黄丹中均含有+2价的铅
C. 胡粉炒为黄丹的过程中发生了氧化还原反应
D. 密陀僧分别与物质的量浓度之比为1:2的稀硫酸和稀硝酸反应,前者反应速率更快
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 5.6 g Fe与过量稀硝酸反应,转移的电子数为0.3NA
B. 标准状况下,2. 24 L苯含C-H键的数目为0.6NA
C. K35ClO3与浓H37 Cl反应制得7.1 g氯气,则生成的Cl2分子数为0.1NA
D. 6.4 g Cu与40 mL 10 mol·L-1浓硝酸充分反应,生成的NO2分子数为0.2NA
难度: 困难查看答案及解析
-
已知NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,下列说法正确的是
A. 氧气是还原产物
B. 还原剂与氧化剂的物质的量之比为1:1
C. 反应物中有水,且反应办程式中水的化学计量数为2
D. 若生成4. 48 1(标准状况下)O2,则反应转移0.8 mol电子
难度: 困难查看答案及解析
-
已知磷酸分子(
 )中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是A. H3 PO2属于三元酸 B. H3 PO2的结构式为

C. NaH2PO2属于酸式盐 D. NaH2PO2溶液可能呈酸性
难度: 困难查看答案及解析
-
已知反应:2NO(g)+2H2 (g)==N2 (g)+2H2O(g)生成N2的初始速率与NO、H2的初始浓度的关系为V=kcx( NO).cy( H2),k是为速率常数。在800℃时测得的相关数据如下表所示。
实验数据
初始浓度
生成N2的初始速率、mol/(L·s)
c(NO)/mol/L
c(H2)/mol/L
1
2.00×10-3
6.00×10-3
1.92×10-3
2
1.00×10-3
6.00×10-3
4.80×10-4
3
2.00×10-3
3.00×10-3
9.60×10-4
下列说法不正确的是
A. 关系式中x=l、y=2
B. 800℃时,k的值为8×104
C. 若800℃时,初始浓度c(NO) =c( H2)=4.00×10-3 mol·L-l,则生成N2的初始速率为5. 12×10-3 mol/(L·s)
D. 当其他条件不变时,升高温度,速率常数是将增大
难度: 困难查看答案及解析
-
向铝粉中添加少量NH4Cl固体并充分混合,其中铝粉在1000℃时可与N2反应制备AlN,下列说法正确的是
A. AlN是一种金属材料
B. AlN与足量氢氧化钠溶液共热时生成氢氧化铝和氨气
C. 少量NH4Cl能够破坏Al表面的Al2O3薄膜
D. AlN与足量盐酸反应的离子方程式为AlN+3H+=Al3++NH3↑
难度: 困难查看答案及解析
-
由下列实验基现象不能推出的结论是
选项
实验
现象
结论
A
甲烷与氯气在光照下反应,将反应后的混合气体通入紫色石蕊试液中
紫色石蕊试液变红且不褪色
混合气体中含有HC1
B
向正已烷中加入催化剂,然后高温热裂解,将产生的气体通入溴水中
溴水褪色
裂解产生的气体中含有乙烯
C
将FeSO4高温分解产生的气体通入品红溶液中
品红溶液褪色
分解产生的气体中含有SO2
D
向FeCI3溶液中滴入几滴30%的H2O2
有气体产生,一段时间后溶液颜色加深
Fe3+能催化H2O2分解且该分解反应为放热反应
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:
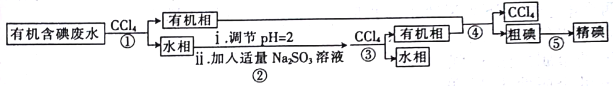
已知:碘的熔点为113℃,但固态的碘可以不经过熔化直接升华。下列说法错误的是
A. 操作①和③中的有机相从分液漏斗下端放出
B. 操作②中发生反应的离子方程式为2IO3- +5SO32-+2H+=I2+5SO42-十H2O
C. 操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、接引管及锥形瓶
D. 操作⑤可用如图所示的水浴装置进行
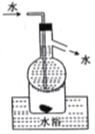
难度: 困难查看答案及解析
-
短周期主族元素V、W、X、Y、Z的原子序数依次增大。由这五种元素组成的九种物质中,n、r、u是气体单质,其余均为化合物;n是黄绿色气体,m是能使湿润的红色石蕊试纸变蓝的无色气体,p是无色液体,q是淡黄色固体。它们的转化关系如图所示。

下列说法正确的是
A. 实验室制取m和u时,气体发生装置可以相同
B. 原子半径:W>X>Y
C. 反应①、②均为置换反应
D. n与t溶液反应时,t作还原剂
难度: 困难查看答案及解析