-
在恒温恒压、不做功时,反应A+B===C+D在下列哪种情况下,一定能自发进行( )
A.ΔH<0、ΔS<0 B.ΔH>0、ΔS<0 C.ΔH<0、ΔS>0 D.ΔH>0、ΔS>0
难度: 简单查看答案及解析
-
下列叙述中,不正确的是 ( )
A.某特定反应的平衡常数仅是温度的函数
B.化学平衡发生移动,平衡常数必发生变化
C.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动
D.催化剂不能改变平衡常数的大小
难度: 简单查看答案及解析
-
下列物质在水溶液中的电离方程式书写正确的是( )
A.CH3COOH===H++CH3COO-
B.NaHSO4===Na++H++SO
C.H3PO4
3H++PO
D.NaHCO3
Na++H++CO
难度: 简单查看答案及解析
-
以NA代表阿伏加德罗常数的值,则关于热化学方程式C2H2(g)+
O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A.当10NA个电子转移时,该反应吸收1300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
难度: 简单查看答案及解析
-
在2A(g)+B(s)
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 12 mol/(L·min) D.υ(D)= 6 mol/(L·min)
难度: 简单查看答案及解析
-
反应A2+B2
2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
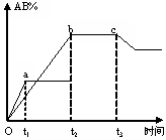
A.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
B.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
C.AB为气体,A2、B2中最少有一种为非气体,正反应放热
D.A2、B2、AB均为气体,正反应放热
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定的溶液中能大量共存的是 ( )
①酸性溶液中:Fe2+、Al3+、NO3-、Cl-、I-
②pH=13的溶液:Na+、CO32-、SO32-、AlO2-、S2-
③水电离出来的c(H+)=10-13 mol/L的溶液:NH 4+、K+、NO3-、S2O32-
④加入铝片能放出H2的溶液:Na+、HCO3-、Cu2+、SO42-
⑤滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、NO3-
A.①② B.②③ C.②④⑤ D.②⑤
难度: 中等查看答案及解析
-
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g),设起始
=Z,在恒压下,平衡时
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )
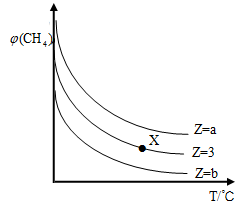
A.该反应的焓变△H﹤0
B.图中Z的大小为b >3> a
C.图中X点对应的平衡混合物中
=3
D.温度不变时,图中X点对应的平衡在加压后
(CH4)减小
难度: 中等查看答案及解析
-
将BaO2放入密闭的真空容器中,反应2BaO2(s)
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变 C.气体密度增大 D.氧气压强不变
难度: 中等查看答案及解析
-
能证明甲酸是弱酸的实验事实是( )
A.HCOOH溶液与Zn反应放出H2
B.0.1mol/L HCOOH溶液的pH大于1
C.HCOOH溶液与NaHCO3反应生成CO2
D.0.1 mol/L HCOOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:mA(g)+nB(g)
pC(g),达到平衡后,保持温度不变,将气体体积扩大到原来的两倍,当达到新平衡时,C的浓度为原来0.6倍,下列说法错误的是( )
A.m+n<p B.平衡向正反应方向移动
C.A的转化率降低 D.C的体积分数增加
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中
减小
B.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
C.稀醋酸中加入少量NaOH固体,溶液的导电性增强
D.向醋酸中加入氨水至中性,溶液中
难度: 中等查看答案及解析
-
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
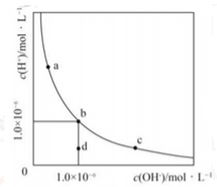
A.升高温度,可能引起有c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,稀释溶液可能引起由c向d的变化
D.该温度下,加入FeCl3可能引起由b向a的变化
难度: 中等查看答案及解析
-
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述错误的是( )
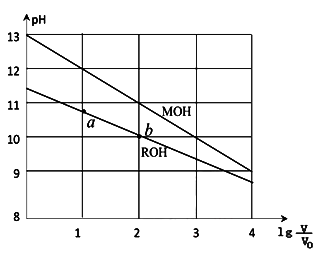
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当
=2时,若两溶液同时升高温度,则
增大
难度: 极难查看答案及解析
-
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O
HClO + H+ +Cl- K2=10-3.4
HClO
H+ + ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )

A.Cl2(g)+ H2O
2H+ + ClO- + Cl- K=10-10.9
B.在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D.氯处理饮用水时,在夏季的杀菌效果比在冬季差
难度: 极难查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器
编号
起始时各物质的物质的量/mo
达平衡时体系能量的变化
N2
H2
NH3
①
1
3
0
放出热量:23.15 kJ
②
0.9
2.7
0.2
放出热量:Q
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.容器②中达平衡时放出的热量Q=23.15 kJ
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.平衡时,两个容器中NH3的体积分数相等
难度: 简单查看答案及解析