-
下列分子含有的电子数目与HF相同,且只有两个极性共价键的是:
A.CO2 B.N2O C.H2O D.CH4
难度: 中等查看答案及解析
-
从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”,据此你认为下列变化属于化学反应的是:
A.对空气进行降温加压 B.金刚石变成石墨
C.NaCl熔化 D.碘溶于CCl4中
难度: 中等查看答案及解析
-
若两物质恰好完全反应,下列各项中反应前后保持不变的是:
①电子总数 ②原子总数 ③分子总数 ④物质的总能量 ⑤物质的总质量
A.①②⑤ B.①③⑤ C.②③④ D.②④⑤
难度: 中等查看答案及解析
-
化学键使得一百多种元素构成了世界的万事万物.关于化学键的下列叙述中,正确的是:
A.离子化合物一定含有共价键,共价化合物中不含离子键
B.共价化合物可能含离子键,离子化合物中只含离子键
C.构成单质分子的粒子一定含有共价键
D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
难度: 中等查看答案及解析
-
X、Y是周期表中的两种元素,X原子的半径比Y的半径小,且具有相同的电子
层数,(选项中m、n均为正整数)下列有关叙述正确的是:
A.若X、Y原子序数相差1,Y为ⅡA族,则X一定是ⅢA族
B.若H n XO m为强酸,则X的氢化物溶液于水一定显酸性
C.若Y元素形成的单质是气体,则X元素形成的单质一定也是气体
D.若Y(OH)m易溶于水,则X(OH)n一定不溶于水
难度: 中等查看答案及解析
-
关于氢键及范德华力,下列说法正确的是:
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔点和沸点升高 C.沸点HI>HBr>HCl>HF
D.H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致
难度: 中等查看答案及解析
-
下列哪个事实能说明氯化氢是共价化合物:
A.氯化氢易溶于水 B.液态氯化氢不导电
C.氯化氢溶于水发生电离 D.氯化氢不易分解
难度: 中等查看答案及解析
-
下列有关物质结构的说法正确的是:
A.共价化合物中各原子最外层都一定满足8电子结构
B.BaO2晶体中阳离子与阴离子数目之比为1∶2
C.H2O是一种非常稳定的化合物,这是由于氢键所致
D.在反应2Na2O2+2H2O == 4NaOH+O2↑,既有离子键、极性键和非极性键的断裂,又有离子键、极性键和非极性键的形成
难度: 中等查看答案及解析
-
下列说法正确的是:
A.钠原子失去一个电子后,它的电子数与氖原子相同,所以变成氖原子
B.任何元素的原子都是由核外电子和核内中子、质子组成的
C.核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素
D.40 18Ar、40 19K、40 20Ca的质量数相同,所以它们是互为同位素
难度: 中等查看答案及解析
-
短周期元素A、B可以形成化合物AB2.下列有关叙述正确的是:
A.若AB2是共价化合物,则A与B的原子序数不可能相差1
B.若AB2是离子化合物,则A与B的原子序数不可能相差8
C.若A与B的原子序数相差5,则离子化合物AB2不溶于水
D.若A与Y的原子序数相差6,则共价化合物AB2不可溶于强碱溶液
难度: 中等查看答案及解析
-
元素周期表中ⅠA族元素有R′和R″两种同位素, R′和R″的相对原子质量分别为a和b,R元素中R′和R″原子的百分组成分别为 x 和 y ,则R元素的碳酸盐的相对分子质量是:
A.2(ax+by)+60 B. ax+by+60 C.(ax+by)/2+60 D. ay+bx+60
难度: 中等查看答案及解析
-
有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
第一组 He -268.8 (a) -249.5 Ar -185.8 Kr -151.7
第二组 F2 -187.0 Cl2 -33.6 (b) 58.7 I2 184.0
第三组 (c) 19.4 HCl -84.0 HBr -67.0 HI -35.3
第四组 H2O 100.0 H2S -60.2 (d) -42.0 H2Te -1.8
下列各项中正确的是:
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中每个原子均满足8电子结构。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是
A.S2Cl2中的硫元素显+1价
B.S2Cl2结构中的化学键只含有极性键
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的生成物中可能有S
难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是:
A. 元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B. 元素X不能与元素Y形成化合物X2Y2
C. 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D. 元素W、R的最高价氧化物的水化物都是强酸
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是:
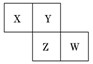
A.只由这四种元素不能组成有机化合物
B.最高价氧化物对应水化物的酸性W比Z弱
C.Z的单质与氢气反应较Y剧烈
D.X、Y形成的化合物都易溶于水
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期主族元素。其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是:
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.Z的氢化物的沸点比X的氢化物的沸点高
D.Y、Z两元素的简单离子的半径Y>Z
难度: 中等查看答案及解析