-
生产、生活离不开各种化学物质,下列说法不正确的是
①二氧化硅是电子工业中常用的半导体材料
②氢氧化铝可用于治疗胃酸过多
③氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
④天然气、石油和煤均属于不可再生能源
⑤用食醋清洗热水瓶中的水垢
⑥用纯碱溶液洗涤餐具上的油污
⑦用米汤检验含碘盐中的碘酸钾
⑧医疗上可用碳酸钡作x射线透视肠胃的内服药,是因为碳酸钡不溶于水
⑨某雨水样品放置一段时间后pH由4.68变为4.00,是因为水中溶解的CO2增多
⑩加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
A.①③④⑦⑩
B.②③④⑤⑥
C.①⑦⑧⑨⑩
D.①②④⑦⑨⑩
难度: 中等查看答案及解析
-
下列实验现象预测正确的是

A.实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B.实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:继续煮沸溶液至红褐色沉淀,停止加热,当光束通过体系时一定不可产生丁达尔效应
难度: 困难查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下7.8gNa2S固体和7.8 gNa2O2固体中含有的阴离子数目均为0.1NA
B.标准状况下,2.24L Cl2和HCl的混合气体中含有的分子总数为2×6.02×1023
C.含1mol FeCl3的饱和溶液滴入沸水中得到胶体数目为NA
D.标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4 NA
难度: 中等查看答案及解析
-
下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)

A.图1:n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
B.图2:n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
C.图3:n(HCl)=1mol时,K2CO3逐步加入到HCl溶液中在敞口容器反应生成的气体
D.图4:n(HNO3)=1mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
难度: 极难查看答案及解析
-
化学方程式是一种重要的化学用语。所写的化学方程式不能用来正确解释化学过程或事实的是
A.熔融烧碱时不能使用石英坩埚:SiO2+2NaOH
Na2SiO3 + H2O
B.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+ →I2 +O2↑+4H2O
C.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g)
Fe3O4+4H2
D.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:
ClO-+Cl-+2H+→Cl2↑+H2O
难度: 困难查看答案及解析
-
化学与人类生产、生活密切相关,下列说法正确的是
A.氮的固定是指将气态氮气变为固态
B.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
C.金属可分为“黑色金属”和“有色金属”,铁及其合金都属于“有色金属”
D.包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同
难度: 中等查看答案及解析
-
下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是
①C与O2 ②Na与O2 ③Fe与Cl2 ④AlCl3溶液与NaOH溶液
⑤CO2与NaOH溶液 ⑥Cu与硝酸
A.除③外
B.除③⑤外
C.除③④外
D.除⑥外
难度: 中等查看答案及解析
-
下列反应先后顺序判断正确的是
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入氯气:I-、Br-、Fe2+
B.在含等物质的量的NaCl、NaBr的溶液中加入硝酸银溶液:Cl-、Br-
C.在含等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+
D.在含等物质的量的H+、Al3+ 的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3
难度: 困难查看答案及解析
-
气体X可能由NH3、Cl2、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生浅黄色沉淀,该沉淀不溶于稀HNO3溶液,若将X通入澄清石灰水中,却不见沉淀产生,则有关气体X的成分的下列说法正确的是
①一定含有HBr,可能含有CO2 ②一定不含CO2
③一定不含NH3、Cl2 ④可能含有Cl2、CO2
A.只有①
B.只有③
C.①和③
D.②和③
难度: 困难查看答案及解析
-
xmLCO2通过足量的Na2O2后再与ymLNO混合,若x与y之和为30mL,充分反应后气体的体积缩小为15mL,则x不可能为
A.10
B.15
C.20
D.25
难度: 简单查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 困难查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是

A.H2SO4浓度为2.5mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中NO3-的物质的量为0.1mol
难度: 困难查看答案及解析
-
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),关于该固体混合物,下列说法正确的是

A.一定含有Al,其质量为4.05g
B.一定不含FeCl2,可能含有MgCl2和AlCl3
C.一定含有MgCl2和FeCl2
D.一定含有(NH4)2SO4、MgCl2,且物质的量相等
难度: 困难查看答案及解析
-
如图,将乙针筒内的物质压到甲针筒内,进行下表所列实验,对实验现象的描述错误的是
(气体在同温同压下测定)

选项
甲针筒内物质
乙针筒内物质
甲针筒的现象
A
20mLH2S
10mLSO2
生成黄色固体,活塞自动向内压缩
B
1g薄铜片
10mL12mol/L浓硝酸
生成棕色气体、溶液呈绿色,活塞自动外移,Cu有剩余
C
30mLNO2
10mL水(液态)
剩有无色气体,活塞自动向内压缩
D
10mLFeSO4溶液
10mLNH3
生成白色沉淀,最终沉淀转变为红褐色
难度: 困难查看答案及解析
-
表中陈述Ⅰ、Ⅱ均正确,且两者在反应原理上相似的是
选项
陈述Ⅰ
陈述Ⅱ
A
向酚酞溶液中加Na2O2,溶液先变红后褪色
向石蕊溶液中通入Cl2,溶液先变红后褪色
B
将SO2和Cl2同时通入BaCl2溶液中,产生白色沉淀
将CO2和NH3同时通入CaCl2溶液中,产生白色沉淀
C
向MgCl2溶液中加入NaOH溶液生成白色沉淀
向FeCl3溶液中加入NaOH溶液生成红褐色沉淀
D
Na投入水中产生大量气泡
Na2CO3投入盐酸中产生大量气泡
难度: 中等查看答案及解析
-
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是
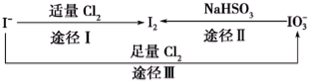
A.可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B.足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O═2HClO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,反应中转移的电子数为10NA
难度: 中等查看答案及解析