-
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Na+、MnO-4、SO2-4
②pH=11的溶液中:CO2-3、Na+、AlO-2、NO-3
③加入Al能放出H2的溶液中:Cl-、HCO-3、SO2-4、NH+4
④由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br一
⑤有较多Fe3+的溶液中:Na+、H+、SCN-、HCO-3
⑥酸性溶液中:Fe2+、Al3+、NO-3、I-、Cl-.
A.①②
B.③⑥
C.②④
D.⑤⑥难度: 中等查看答案及解析
-
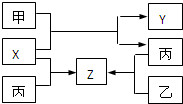
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.X2Y可能是离子化合物,也可能是共价化合物
D.两元素形成的化合物中,原子个数比不可能为1:1难度: 中等查看答案及解析
-
下列实验中操作及现象与结论对应关系正确的一组是( )
实验操作 实验现象 实验结论 A 适量二氧化碳通入氯化钡溶液中 产生白色沉淀 碳酸的酸性比盐酸弱 B 二氧化硫通入溴水中 溶液褪色 二氧化硫有漂白性 C 取少量某无色溶液,先滴加氯水,再加入少量四氯化碳,振荡、静置 溶液分层,下层呈紫红色 原无色溶液中一定有碘离子 D 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 产生红色沉淀 淀粉水解可生成葡萄糖
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
NO2是导致光化学烟雾的“罪魁祸首”之一.NO2可以用氢氧化钠溶液吸收,或在一定条件下用氨气(NH3)与其反应使之转化为无污染的物质,发生反应的化学方程式分别是:2NO2+2NaOH=M+NaNO3+H2O,8NH3+6NO2=7X+12H2O.则M和X代表的物质的化学式是( )
A.NaNO2、N2
B.HNO2、N2
C.NO、HNO3
D.Na3NO4、NO难度: 中等查看答案及解析
-
2008年12月,卫生部印发首批非法食品添加剂名单.下列在食物中的添加剂(括号内物质)不属于非法食品添加剂的是( )
A.海参(甲醛)
B.白酒(甲醇)
C.奶粉(三聚氰胺)
D.食盐(KIO3)难度: 中等查看答案及解析
-
下列物质中,不能用于消除硫酸工业尾气中二氧化硫的是( )
A.氨水
B.品红溶液
C.石灰石
D.熟石灰难度: 中等查看答案及解析
-
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
A.蒸馏水、氨水、氧化铝、二氧化硫
B.纯盐酸、空气、硫酸、干冰
C.胆矾、盐酸、铁、碳酸钙
D.生石灰、漂白粉、氯化铜、碳酸钠难度: 中等查看答案及解析
-
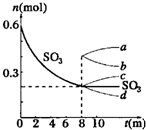
如图是恒温下某化学反应的反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( )
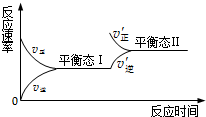
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等难度: 中等查看答案及解析
-
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后两个烧瓶内溶液的关系是(两烧瓶内充满溶液且不考虑溶质的扩散)( )
A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同,溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值.下列说法正确的是( )
A.在铜和稀硝酸的反应中,当转移NA个电子时,产生气体的体积约为11.2L
B.常温常压下,49gH2SO4所含的原子数为3.5NA
C.标准状况下,0.5NA个Br2分子所占的体积约为11.2L
D.常温常压下,将0.5molHI气体和0.5molCl2混合后,气体的分子总数为NA难度: 中等查看答案及解析
-
已知下述三个实验均能发生化学反应
(1)将铁钉放入硫酸铜溶液中;
(2)向硫酸亚铁溶液中滴入几滴浓硝酸;
(3)将铜丝放入氯化铁溶液中.
下列判断正确的是( )
A.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
B.实验(2)中Fe2+既显氧化性又显还原性
C.实验(3)中发生是置换反应
D.实验(1)中铁钉只做还原剂难度: 中等查看答案及解析
-
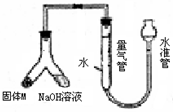
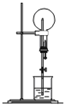
下列实验操作正确的是( )
A.氢氧化钠固体放在滤纸上称量
B.用如图所示的装置可以测定黄铜(Cu、Zn合金)中Zn的含量
C.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是H2O、Ba(OH)2、Na2CO3、HCl
D.配制0.184mol/L H2SO4时,向1000mL容量瓶中注入10mL18.4mol/L H2SO4然后边加水边震荡,最后定容难度: 中等查看答案及解析
-
如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
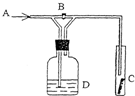
A.浓H2SO4
B.饱和NaCl溶液
C.浓NaOH溶液
D.浓NaBr溶液难度: 中等查看答案及解析
-
如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,一定条件下可与铁粉反应
④W的原子序数比Z大9.
A.只有③
B.①②
C.①②③
D.①②③④难度: 中等查看答案及解析
-
“信息”、“材料”和“能源”被称为新科技革命的三大支柱.下列有关资讯错误的是( )
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率
C.2008年9月25日发射成功的“神舟七号”载人飞船使用了大量的复合材料
D.合成高分子材料的广泛应用是有百利而无一害难度: 中等查看答案及解析
-
硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
下列说法正确的是( )
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行难度: 中等查看答案及解析
-
27.2g铁粉和氧化铁的混合物,放入500mL稀H2SO4中,发现固体完全溶解,并放出4.48L H2(标况),加入NH4SCN溶液后,无颜色变化,然后向溶液中加入2mol•L-1 NaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为( )
A.4mol•L-1
B.3mol•L-1
C.2mol•L-1
D.1mol•L-1难度: 中等查看答案及解析