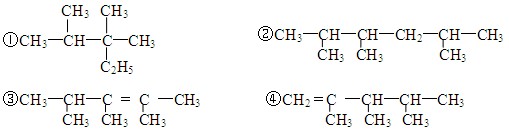-
下列试剂的储存方法正确的是
A.浓硝酸存放在棕色广口试剂瓶中
B.少量白磷存放在煤油中
C.盛溴的试剂瓶里加少量水以减少溴的挥发
D.将浓盐酸与浓氨水存放在同一层药品橱里
难度: 中等查看答案及解析
-
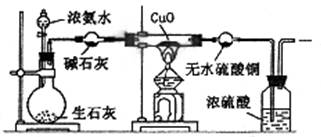
下列气体的制备可采用下图装置的是

A.铜与浓硝酸反应制NO2
B.铜与稀硝酸反应制NO
C.乙醇与浓硫酸反应制乙烯
D.氯化钠与浓硫酸反应制HCl
难度: 中等查看答案及解析
-
进行化学实验,观测实验现象,通过分析推理得出正确的结论是学习化学的方法之一。对下列实验事实的解释正确的是
A.在KI淀粉溶液中通入Cl2,溶液变蓝,说明氯气能与淀粉发生显色反应
B.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色产物生成且能溶于浓硝酸
C.在某溶液中加入HNO3酸化的BaCl2溶液有白色沉淀产生,说明溶液中含有SO42-
D.将铜片放入浓硫酸中无明显实验现象,说明铜在冷的浓硫酸中发生钝化
难度: 中等查看答案及解析
-
实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
A.CH3COONa固体 B.NaOH溶液 C.(NH4)2SO4粉末 D. K2SO4固体
难度: 中等查看答案及解析
-
在2 L的密闭容器中发生反应:2SO2 + O2
2SO3,如果2 min内SO2的量由12 mol
下降为4 mol,则下列说法正确的是
A.用SO2的浓度变化表示的反应速率为4 mol/(L·min)
B.用O2的浓度变化表示的反应速率为2 mol/(L·min)
C.增大压强,正反应速率增大,逆反应速率减小
D.升高温度,正反应速率和逆反应速率都增大
难度: 中等查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是
A. 水的离子积变大、pH变小、呈酸性 B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变小、pH变大、呈碱性 D. 水的离子积变大、pH变小、呈中性
难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是
A.铁在潮湿的环境下生锈 B.纯碱溶液去油污
C.加热氯化铁溶液颜色变深 D.草木灰不宜与用作氮肥的铵盐使用
难度: 中等查看答案及解析
-
如下图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。如果刻度A和D都是4,则两处液面的读数是

A.Ⅰ中是3.2 mL,Ⅱ中是5.40 mL
B.Ⅰ中是4.8 mL,Ⅱ中是3.40 mL
C.Ⅰ中是3.2 mL,Ⅱ中是4.60 mL
D.Ⅰ中是4.8 mL,Ⅱ中是4.60 mL
难度: 中等查看答案及解析
-
CH4中混有CH2=CH2,可将混合气通入下列物质而除去CH2=CH2的是
A.氢氧化钠溶液 B.水 C.溴水 D.浓硫酸
难度: 中等查看答案及解析
-
试管中盛有少量白色固体,可能是铵盐,检验的方法是
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,滴入紫色石蕊试液
C.加氢氧化钠溶液,加热,滴入无色酚酞试液
D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
难度: 中等查看答案及解析
-
反应 X(气)+ Y(气)
2Z(气);△H=Q(Q>0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是

A.加催化剂 B.降低温度 C.增大压强 D.增大Y的浓度
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.在AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B.在CuSO4溶液中加入过量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓
C.氨气通入醋酸溶液中:NH3+CH3COOH=CH3COO-+NH4+
D.碳酸钙中加入盐酸:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
实验室需配制一种仅含四种离子(不包括不电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为1mol/L.下面四个选项能达到此目的的是
A.Ca2+、K+、CO32-、Cl- B.Na+、Mg2+、Cl-、SO42-
C.Fe2+、Na+、NO3-、SO42- D.Na+、Al3+、NO3-、Cl-
难度: 中等查看答案及解析
-
仔细分析下列表格中烃的排列规律,判断排列在第15位的烃的分子式是
1
2
3
4
5
6
7
8
9
……
C2H2
C2H4
C2H6
C3H4
C3H6
C3H8
C4H6
C4H8
C4H10
……
A.C6H12 B.C6H14 C.C7H12 D.C7H14
难度: 中等查看答案及解析
-
在用锌片、铜片和稀硫酸组成的原电池装置中,经过—段时间工作后,下列说法正确的是
A.锌片是正极,铜片是负极 B.电子是从锌片通过导线流到铜片上
C.溶液中H+移向锌片被还原成H2 D.电解液的pH逐渐变小
难度: 中等查看答案及解析
-
实验室现有3种酸碱指示剂,其pH变色范围如下
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.1000mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
难度: 中等查看答案及解析