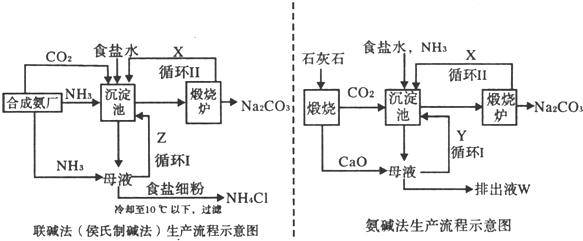
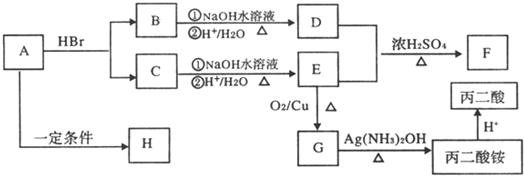
-
化学用语是学习化学的重要工具.下列用来表示物质变化的化学用语中,错误的是( )
A.钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-=4OH-
B.表示H2燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
C.纯碱水解的离子方程式:CO32-+H2OHCO3-+OH-
D.Ca(HCO3)2溶液中加入过量澄清石灰水:难度: 中等查看答案及解析
-
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是:①分子具有7个碳原子的芳香烃②分子中具有4个碳原子的烷烃③分子中具有12个氢原子的烷烃④分子中具有8个碳原子的烷烃( )
A.①②
B.②③
C.③④
D.②④难度: 中等查看答案及解析
-
气态烃0.5mol能与1mol HCl加成,转变为氯代烷烃,加成后产物分子上的氢原子又可被3mol Cl2完全取代,则该烃可能是( )
A.CH≡CH
B.CH≡CCH3
C.CH3C≡CCH3
D.CH2=CHCH3难度: 中等查看答案及解析
-
25℃时,20.00mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466g沉淀.滤液跟2mol/l NaOH溶液反应,共用去10.00ml碱液时恰好中和.下列说法中正确的是( )
A.原混合液中c(SO42-)=0.2mol/L
B.原混合液中c(NO3-)=0.9mol/L
C.原混合液中pH=0
D.原混合液中由水电离出的c(H+)=0.1mol/L难度: 中等查看答案及解析
-
下列实验报告记录的实验现象正确的是( )
实验 
记录 A 无色 无色 无现象 无色溶液 B 红色 无色 白色沉淀 白色沉淀 C 红色 无色 无色溶液 白色沉淀 D 无色 无色 无色溶液 无色溶液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
气体X可能是Cl2、HBr、CO2中的一种或几种,已知X通入AgNO3溶液时产生淡黄色沉淀,且沉淀不溶于稀硝酸,若将X通入澄清的石灰水中却不见沉淀产生,则对气体X的成分下列说法正确的是( )
A.一定含有HBr,一定不含CO2
B.一定含有HBr,可能含有CO2
C.一定不含CO2、Cl2
D.可能含有CO2、Cl2难度: 中等查看答案及解析
-
MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600¾-700¾,所用燃料为H2,电解质为熔融的K2CO3.已知该电池的总反应为2H2+O2═2H2O,则下列有关该电池的说法正确的是( )
A.该电池的正极的反应式为:4OH-+4e-═O2+2H2O
B.该电池负极的反应为:H2+CO32--2e-═H2O+CO2
C.放电时CO32-向正极移动
D.该燃料电池能量转化率很低难度: 中等查看答案及解析