-
(15分)苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:

已知:
名称
相对分子质量
颜色,状态
沸点(℃)
密度(g·cm-3)
苯甲酸*
122
无色片状晶体
249
1.2659
苯甲酸乙酯
150
无色澄清液体
212.6
1.05
乙醇
46
无色澄清液体
78.3
0.7893
环己烷
84
无色澄清液体
80.8
0.7318
*苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
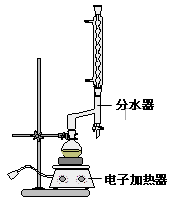
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是 (填入正确选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是 。
(3)步骤②中应控制馏分的温度在 。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)步骤③加入Na2CO3的作用是 ;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是 。
(5)关于步骤③中的萃取分液操作叙述正确的是 。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为 。
难度: 极难查看答案及解析