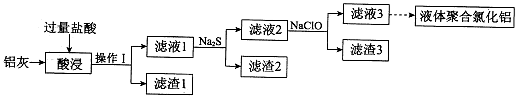
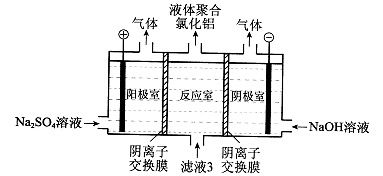
-
下列说法正确的是
A.油脂都不能使溴水褪色
B.氨基酸是两性化合物,能与酸、碱反应生成盐
C.福尔马林可用作食品防腐剂
D.蔗糖和麦芽糖的水解产物都是葡萄糖
难度: 简单查看答案及解析
-
用下列各组仪器或装置,不能达到实验目的的是
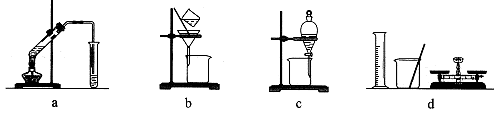
A.a组:制备少量乙酸乙酯
B.b组:除去粗盐水中的泥沙
C.c组:用CCl4提取碘水中的碘
D.d组:配制100 mL 1.00 mol/L NaCl溶液
难度: 简单查看答案及解析
-
下列解释事实的离子方程式不正确的是
A.氯化铜溶液显酸性:Cu2++2H2O
Cu(OH)2+2H+
B.氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-=2 Cl-+I2
C.向硫酸铝溶液中加入氨水出现白色胶状沉淀:Al3++3OH-=Al(OH)3↓
D.实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:SiO2+2 OH-= SiO32-+H2O
难度: 中等查看答案及解析
-
已知16S、34Se位于同一主族,下列关系正确的是
A.热稳定性:H2Se> H2S> HClB.原子半径:Se>P>Si
C.酸性:H3PO4>H2SO4>H2SeO4 D.还原性:Se2->Br->Cl-
难度: 中等查看答案及解析
-
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.c(H+)=c(CHCOO-)+c(OH-)
B.加入少量CH3COONa固体后,c(CH3COO—)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
难度: 中等查看答案及解析
-
欲检验CO2气体中是否含有SO2、HC1,进行如下实验:
①将气体通入酸化的AgNO3溶液中,产生白色沉淀a;
②滤去沉淀a,向滤液中加入Ba(NO3)2溶液,产生白色沉淀b。
下列说法正确的是
A.沉淀a为AgC1 B.沉淀b为BaCO3
C.气体中含有SO2 D.气体中没有HC1
难度: 中等查看答案及解析