-
在下列反应中,水既不作氧化剂,又不作还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑ B.Na2O+ H2O=2NaOH
C.H2O
H2↑+O2↑ D.C+H2O
CO+H2
难度: 简单查看答案及解析
-
银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪。制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了。“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是
A.硫的还原性 B.硫的漂白性
C.二氧化硫的还原性 D.二氧化硫的漂白性
难度: 简单查看答案及解析
-
少量的金属钠长期暴露在空气中,它的最终产物是
A.NaOH B.Na2CO3·10H2O
C.Na2CO3 D.NaHCO3
难度: 简单查看答案及解析
-
下列装置所示的实验中,能达到实验目的的是

A.分离碘和酒精 B.除去Cl2中的HCl C.实验室制氨气 D.排水法收集NO
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B.氯气跟水反应:Cl2 + H2O= H+ + Cl- + HClO
C.钠与水的反应:Na+H2O=Na++OH-+H2↑
D.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列有关说法正确的是
A.3mol NO2与足量H2O反应,转移的电子数为NA
B.常温常压下,22.4L氦气含有NA个氦原子
C.标准状况下,22.4L单质溴所含有的原子数目不为2NA
D.钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA
难度: 简单查看答案及解析
-
根据元素在周期表中的位置判断,下列元素中原子半径最小的是
A.氧 B.氟 C.碳 D.氮
难度: 简单查看答案及解析
-
下列物质中,含有非极性共价键的是
A.N2 B.CO2 C.NaOH D.CH4
难度: 简单查看答案及解析
-
下列有关元素周期律的叙述中,正确的是
A.氧化性强弱:F2<Cl2 B.金属性强弱:K<Na
C.酸性强弱:H3PO4<H2SO4 D.碱性强弱:NaOH<Mg(OH)2
难度: 简单查看答案及解析
-
X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化合物的化学式可能是
A.XYZ B.X3YZ C.XYZ2 D.X2YZ3
难度: 简单查看答案及解析
-
含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是
A.非金属性比硫强 B.氢化物比HBr稳定
C.原子序数为34 D.最高价氧化物的水化物显碱性
难度: 简单查看答案及解析
-
A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为
A.n+32 B.n+20 C.n+18 D.n+83
难度: 简单查看答案及解析
-
下列反应中,属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2?8H2O与NH4Cl反应 B.铝与稀盐酸
C.灼热的炭与CO2反应 D.甲烷与O2的燃烧反应
难度: 简单查看答案及解析
-
下列关于化学键的说法中正确的是
A.构成单质分子的微粒一定含有共价键
B.由非金属组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
难度: 简单查看答案及解析
-
有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4溶液中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4溶液中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4溶液,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应,则四种金属的活动性顺序为
A.A>B>C>D B.C>A>B>D C.A>C>D>B D.B>D>C>A
难度: 简单查看答案及解析
-
下列除去杂质的方法正确的是
A.除去CO2中的少量CO:通入O2,点燃
B.除去Na2CO3稀溶液中的少量NaHCO3:加热
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
难度: 简单查看答案及解析
-
某溶液中有NH4+、Mg2+、Fe2+、和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
难度: 简单查看答案及解析
-
往100 mL 1mol/L的AlCl3溶液中滴加1mol/L的NaOH溶液,得到5.85g沉淀,则加入NaOH溶液的体积可能是
A.200 mL B.225mL C.300 mL D.325 mL
难度: 简单查看答案及解析
-
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e-==4H2O、O2+2H2O+4e-==4OH-,下列说法错误的是
A.氢气通入正极,氧气通入负极
B.燃料电池的能量转化率不能达到100%
C.供电时的总反应为:2H2+O2 ="===" 2H2O
D.产物为无污染的水,属于环境友好电池
难度: 简单查看答案及解析
-
右图是可逆反应X2 + 3Y2
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
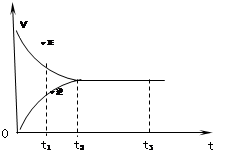
A.t1时,只有正方向反应
B.t2时,反应没有到达限度
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度不再发生变化
难度: 简单查看答案及解析

