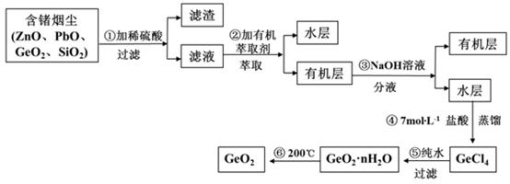
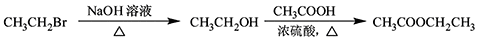-
下列用品的主要成分及其用途对应不正确的是
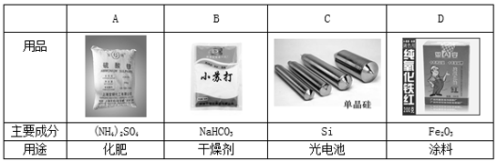
难度: 简单查看答案及解析
-
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中采用图3所示装置进行铜与稀硝酸的反应
④实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
A.②③④ B.①②④ C.①②③ D.①③④
难度: 中等查看答案及解析
-
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是
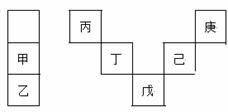
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物不与任何酸反应
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说中正确的是
A.W、X、Y、Z原子的核外最外层电子数的总和为22
B.上述四种元素的原子半径大小为W<X<Y<Z
C.有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
D.W与Y可形成既含极性共价键又含非极性共价键的化合物
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出结论正确的是
编号
实验操作
实验现象
解释与结论
A
某溶液加入浓NaOH溶液,加热,在试管口放一片湿润的红色石蕊试纸
试纸变蓝
NH3是碱
B
硝酸银溶液中加入足量NaCl溶液,再加入KI溶液
先出现白色沉淀,后变为黄色沉淀
KSP(AgCl)>KSP(AgI)
C
2ml2%CuSO4中加4-6滴2%NaOH,振荡后加入0.5mlX溶液,加热煮沸
未出现砖红色沉淀
X不含有醛基
D
等体积pH=3的HA和HB两种酸分别与足量的锌反应
相同时间内,HA收集到氢气多
HA是强酸
难度: 中等查看答案及解析
-
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:
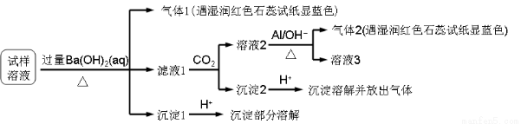
已知:3NO3- + 8Al + 5OH- + 2H2O = 3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
C.试样中可能存在Na+、Cl-
D.试样中一定不含Al3+
难度: 中等查看答案及解析
-
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是60 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
难度: 中等查看答案及解析




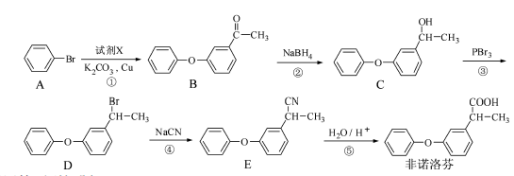
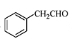 为原料制备
为原料制备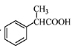 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: