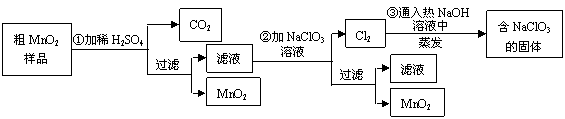-
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A、常温下,23g NO2含有NA个氧原子
B、1L0.1mol•L-1的氨水含有0.1NA个OH―
C、常温常压下,22.4LCCl4含有个NA个CCl4分子
D、1molFe2+ 与足量的H2O2溶液反应,转移2NA个电子
难度: 简单查看答案及解析
-
下列叙述正确的是
A.1.00mol NaCl中含有6.02×1023个NaCl分子
B. 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D.电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
难度: 简单查看答案及解析
-
设NA是阿伏加德罗常数的数值,下列说法正确的是
A.1molAl3+离子含有的核外电子数为3NA
B.1molCl2与足量的铁反应,转移的电子数为3NA
C.10LpH=1的硫酸溶液中含有的H+离子数为2NA
D.10LpH=13的NaOH溶液中含有的OH-离子数为NA
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数,下列叙述错误的是
A.18gH2O中含的质子数为10NA
B.12g 金刚石含有的共价键数为4NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.1 mol Na 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.1mol甲醇中含有C—H键的数目为4NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.标准状况下,2.24L已烷含有分子的数目为0.1NA
D.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.饱和氯水中 Cl-、NO3-、Na+、SO32-
B.c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br-
C.Na2S溶液中 SO42-、 K+、Cl-、Cu2+
D.pH=12的溶液中 NO3-、I-、Na+、Al3+
难度: 简单查看答案及解析
-
在水溶液中大量共存的一组离子是
A. H+、I―、NO3―、SiO32- B. Ag+、Fe3+、Cl―、SO42―
C.K+、SO42-、Cu2+、NO3― D.NH4+、OH-、Cl-、HCO3-
难度: 简单查看答案及解析
-
足量CO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SiO32-、Cl-、NO3- B.H+、NH4+、Al3+、SO42-
C.Na+、S2-、OH-、SO42- D.Na+、C6H5O-、CH3COO-、HCO3-
难度: 简单查看答案及解析
-
(2011上海)某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. Na+ B.SO42- C. Ba2+ D.NH4+
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
难度: 简单查看答案及解析
-
(2011海南)下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. KClO3和K2SO4 D. Na2SO3和BaCO3
难度: 简单查看答案及解析
-
不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑他们间的相互反应)的试剂组是
A. 盐酸、硫酸 B. 盐酸、氢氧化钠溶液
C. 氨水、硫酸 D. 氨水、氢氧化钠溶液
难度: 简单查看答案及解析
-
(重庆)在实验室进行下列实验, 括号内的实验用品都能用到的是
A.硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体)
B.蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液)
C.钠的焰色反应(铂丝、氯化钠溶液、稀盐酸)
D.肥皂的制取(蒸发皿、玻璃棒、甘油)
难度: 简单查看答案及解析
-
四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有SO42-
B
滴加氯水和CCl4,振荡、静置
下层溶液显紫色
原溶液中有I-
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+,无K+
D
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
难度: 简单查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.已知I3-
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
难度: 简单查看答案及解析
-
下列有关实验原理或实验操作正确的是
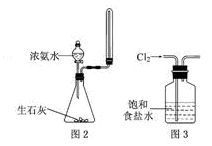
A.用水湿润pH试纸测量某溶液的pH
B.用量筒量取20 mL0.5000 mol·L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol·L-1H2SO4溶液
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置除去Cl2中的少量HCl
难度: 简单查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
溶液呈红色
稀HNO3将Fe氧化为Fe3+
B
Agl沉淀中滴入稀KCl溶液
有白色沉淀出现
AgCl比Agl更难溶
C
Al箔插入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
难度: 简单查看答案及解析