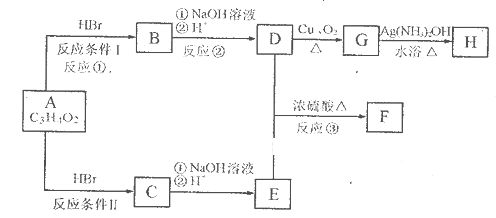
-
化学在生产和日常生活中有着重要的作用。下列有关说法不正确的是
A.氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应
B.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
C.我国发射的嫦娥系列卫星中使用的碳纤维,是一种新型无机非金属材料
D.只要符合限量,“食用色素”、“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂
难度: 简单查看答案及解析
-
下列叙述正确的是
A.在电解池的阴极和原电池的负极上都发生氧化反应
B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2
D.用惰性电极电解饱和NaCl溶液,若有lmol电子转移,则生成l molNaOH
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.铁生锈、白磷燃烧均为自发放热过程
B.冰融化过程其熵值增大
C.高温高压下可以使石墨转化为金刚石是自发的化学反应
D.同一物质固态时熵值最小
难度: 简单查看答案及解析
-
下列有关化学实验的说法中正确的是
A.烧杯、坩埚、试管、锥形瓶都可以用酒精灯直接加热
B.银镜反应、乙醛与新制Cu(OH)2反应、实验室制取乙烯都必须用水浴加热
C.制取氨气、氢气时都可以用向下排空气法收集
D.石油的分馏、实验室制取乙炔和制取蒸馏水都要用到冷凝装置
难度: 简单查看答案及解析
-
下列说法正确的是;
A.用石墨作电极,电解1mol/LNa2CO3的溶液,溶液的pH值保持不变
B.非金属元素呈现的最高化合价不超过该元素的最外层电子数
C.含8gNaOH的溶液中通入一定量的H2S后,将所得溶液小心蒸干,得无水物7.9g,则该无水物中一定含有Na2S
D.使用清洁的天然气是快速、有效地减缓大气中二氧化碳大量增加的生态学措施
难度: 中等查看答案及解析
-
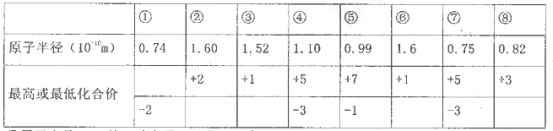
A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-
C具有相同的电子层结构,下列叙述一定不正确的是
A.离子半径
B.它们的原子半径C>B>A
C.它们的原于序数A>B>C
D.原子最外层上的电子数C>A>B
难度: 中等查看答案及解析
-
某课外活动小组用如图所示装置进行实验(电解液足量)。
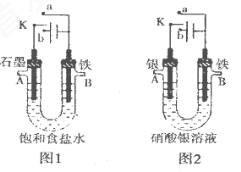
下列说法中错误的是
A.圈l中,若开始实验时开关K与a连接,则B极的电极反应式为
B.图l中,若开始实验时开关K与b连接,则一段时间后向电解液中通入适量HCl气体可恢复到电解前的浓
C.图2中,若开始实验时开关K与a连接,则电解液的溶质质量分数变小
D.图2中,若开始实验时开关K与b连接,则A极减少
的质量等于B极增加的质量
难度: 中等查看答案及解析
-
若溶液中由水电离产生的c (OH-)=l×l0
mol
,满足此条件的溶液中一定可以大量共存的离子组是:

难度: 中等查看答案及解析
-
下列说法正确的是:
A相同温度时,1mol/L氨水与05mol/L氨水中,c(OH-)之比是2:1
B.1mol/L氯化铵 溶液中c(NH4+)=c(Cl-)
C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中
D.硫化钠溶液中,
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.用惰性电极电解饱和氯化钠溶液:

B.用银氨溶液检验乙醛中的醛基:

C.苯酚钠溶液中通入少量
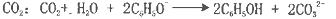
D.Na与乙醇反应:
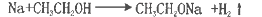
难度: 中等查看答案及解析
-
在25ml 0. 1mol
NaOH溶液中逐滴加入。0.2mol
CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
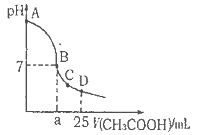
A.在A、B间任一点(不含A、B点),溶液中可能有
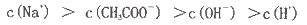
B.在C点,
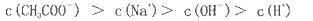
C.在B点,
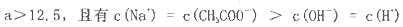
D.在D点,
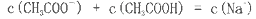
难度: 中等查看答案及解析
-
分析下表中各项的排布规律,有机物M是按此规律排布的第19项,其中能发生银镜反应又属于 酯类的M的同分异构体(不考虑立体异构)有

难度: 中等查看答案及解析
-
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为
A.0.24mol B.0.21mol C.0.25mol D.0.12mol
难度: 中等查看答案及解析
-
T℃时在2L的密闭容器中X(g)与Y (g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图l所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
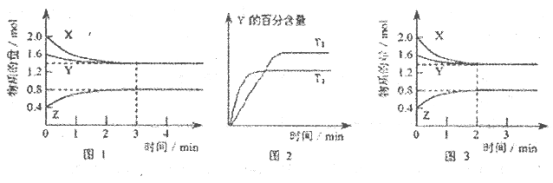
A.容器中发生的反应可表示为
B.反应进行的前3 min内,用X表示的反应速率
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
难度: 中等查看答案及解析
-
下列说法正确的是:
A.在100℃、101kPa条件下,液态水的气化热为40. 69 kJ·mol
,则
B.已知MgCO3的Ksp=6.82×10
,则所有含有固体MgCO3的溶液中,都有

C.己知:

则可以计算出反应


D.常温下,在0.10mol
的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的PH减小
难度: 中等查看答案及解析
-
已知PbI2的Ksp=7.0×10-9,将7.5×10-3 mol/L的KI与某浓度的Pb(NO3)2溶液按体积比为2:1混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为

难度: 中等查看答案及解析
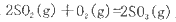 反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的
反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的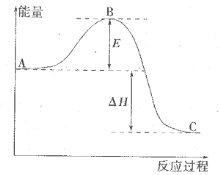

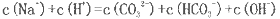
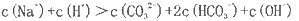

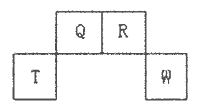

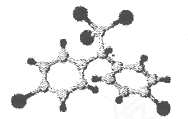
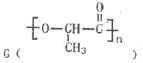 是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到
是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到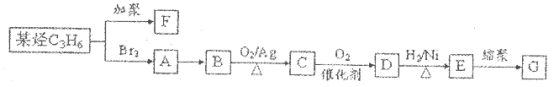
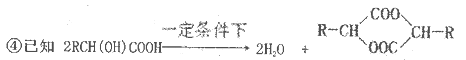
 ,起始原料的某烃的结构简式
,起始原料的某烃的结构简式