-
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A.土壤胶体带负电荷,有利于铵态氮肥的吸收
B.加工后具有吸水性的植物纤维可用作食品干燥剂
C.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
D.燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
难度: 简单查看答案及解析
-
下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水玻璃
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、生石膏、冰醋酸、氨水
④酸性氧化物:SiO2 Mn2O7 N2O5 Cl2O7
A.①④ B.②③ C.③④ D.③
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.44.Og14CO2与14N2O的混合物中所含中子数为22NA
B.标准状况下,2.24L甲醛所含o键数目为0.3NA
C.常温常压下,4.5gH2O与足量Na2O2反应转移的电子数目为0.5 NA
D.50mL 18mol/L硫酸与足量Cu共热,转移的电子数为0.9NA
难度: 中等查看答案及解析
-
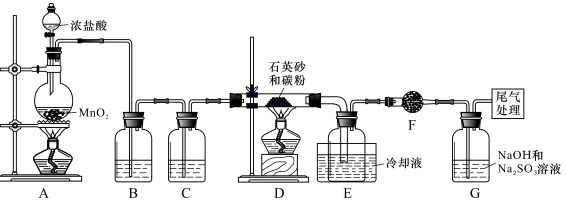
下列有关化学用语表示正确的是
A.乙醇的分子式:C2H5OH
B.C的基态原子核外电子轨道表示式:

C.氯化铵的电子式:
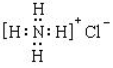
D.CS2分子比例(填充)模型:

难度: 简单查看答案及解析
-
下列药品保存方法正确的是
A. 短期保存Br2:盛于磨口的细口瓶中,并用水封,瓶盖严密。
B. 锂、钠、钾都保存在煤油中,密封。
C. 氨水、浓盐酸易挥发必须保存在棕色磨口细口瓶中。
D. 红磷无需密封保存。
难度: 简单查看答案及解析
-
下列微粒在指定条件下可以大量共存的是:
A.在小苏打溶液中:NO3-、AlO2-、NH4+、K+
B.在空气中:H2S、CO2、SO2、CO
C.在酸性高锰酸钾溶液中:C2H5OH、Na+、SO42-、CO32-
D.在pH=8的溶液中:Na+、HCO3-、Br-、Mg2+
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.NaAlO2溶液中通入过量的CO2: 2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
B.向海带灰浸出液中加入稀硫酸、双氧水:2I-+2H++H2O2=I2+ 2H2O
C.磨口玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O
D.NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+ OH-+ Ba2+=H2O+BaCO3↓
难度: 中等查看答案及解析
-
水溶液X中只可能溶有Na+、Ca2+、Fe3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液迸行了如下实验:

下列判断正确的是
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸钙的混合物
C.Na+、AlO2-和SiO32-一定存在于溶液X中
D.CO32-和SO42-一定不存在于溶液X中
难度: 困难查看答案及解析
-
工业上曾经通过反应“3Fe+4NaOH
Fe3O4+2H2↑4Na↑”生产金属钠,己知铁的熔点1535℃、沸点3000℃。下列有关说法正确的是
A.增大铁的量可以使反应速率加快
B.将生成的气体在空气中冷却可获得钠
C.每生成1molH2,转移的电子数约为4×6.02×1023
D.该反应条件下铁的金属性比钠强
难度: 中等查看答案及解析
-
次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e- =O2↑+4H+
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D.H3PO2溶于水的电离方程式为H3PO2
H++ H2PO2-
难度: 中等查看答案及解析
-
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O。下列有关说法不正确的是
A.由电子转移守恒和氯元素守恒可推出2b+a=6c
B.若氯酸分解所得混合气体,在相同状态下密度是氢气的25.75信,则反应方程式可表示为:
5HClO3=O2↑+Cl2↑+3HClO4+H2O
C.由非金属性Cl>S,可推知酸性HClO4>H2SO4
D.若化学计量数a=3,b=2,则该反应转移电子数为10e-
难度: 困难查看答案及解析
-
下列实验操作能达到实验目的的是

难度: 中等查看答案及解析
-
下列有关实验操作的叙述错误的是
A.清洗仪器时,判断洗涤干净的标准是器壁内出现均匀水膜,既不聚咸水滴,也不成股流下
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.向容量瓶转移液体时,引流用玻璃棒可以接触容量瓶内壁
难度: 简单查看答案及解析
-
下列有关实验装置的说法中正确的是
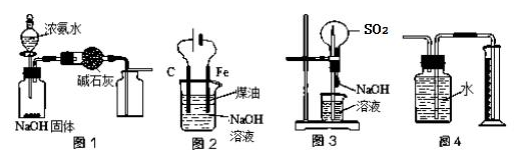
A. 用图1装置制取干燥纯净的NH3
B. 实验室可以用图2装置制备Fe(OH)2
C. 用图3装置可以完成“喷泉”实验
D. 用图4装置测量Cu与浓硝酸反应产生的NO2体积
难度: 中等查看答案及解析
-
类比推理是化学中常用的思维方法。下列推理正确的是
A.CO2是直线型分子,推测CS2也是直线型分子
B.SiH4的沸点高于CH4,推测HCl的沸点高于HF
C.Fe与Br2反应生成FeBr3,推测Fe与I2反应生成FeI3
D.NaCl与浓H2SO4加热可制HC1,推测NaI与浓H2SO4加热可制HI
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如下图所示(反应条件己略去)。下列有关物质的推断正确的是

难度: 中等查看答案及解析
-
将足量的X气体通入Y溶液中,实验结果与预测的现象一致的组合是
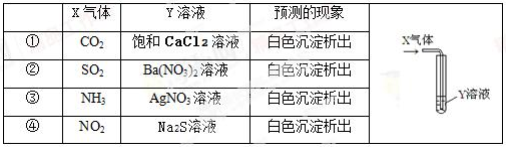
A. 只有①②③ B. 只有①② C. 只有② D. ②④
难度: 中等查看答案及解析
-
某铁的氧化物(FexO) 5.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mLCl2,恰好将Fe2+完全氧化。则x值为
A.0.80 B.0.85 C.0.70 D.0.90
难度: 中等查看答案及解析