-
下列各电离方程式中,书写正确的是
A.CH3COOH
H++CH3COO- B.KHSO4
K++H++S
C.Al(OH)3===Al3++3OH- D.NaH2PO4
Na++H2P
难度: 中等查看答案及解析
-
一定条件下,可逆反应C(s)+CO2(g)
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
难度: 中等查看答案及解析
-
一定条件下,化学反应2H2+O2===2H2O的能量变化如图所示,则反应的热化学方程式可表示为

A.H2(g)+
O2(g)===H2O(g) ΔH=(a+b) kJ/mol
B.2H2(g)+O2(g)===2H2O(g) ΔH=2(b-a) kJ/mol
C.H2(g)+
O2(g)===H2O(l) ΔH=(b+c-a) kJ/mol
D.2H2(g)+O2(g)===2H2O(l) ΔH=2(a-b-c) kJ/mol
难度: 中等查看答案及解析
-
不能用来说明金属X比金属Y还原性强的是
A.把X和Y组成的合金放于潮湿的空气中,X先被腐蚀
B.X原子最外层电子数比Y原子最外层电子数少
C.X能从Y的盐溶液中把Y置换出来
D.电解X和Y的盐的混合液,阴极上先析出Y
难度: 中等查看答案及解析
-
下列叙述正确的是
A.金属腐蚀就是金属原子失去电子被还原的过程
B.钢铁吸氧腐蚀时,负极反应式为2H2O+O2+4e-===4OH-
C.向醋酸钠溶液中加入适量醋酸至混合液pH=7时,溶液中c(Na+)=c(CH3COO-)
D.0.1 mol/L NH4Cl溶液中,c(N
)+c(H+)=c(Cl-)
难度: 中等查看答案及解析
-
已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH1=-176 kJ/mol
②NH3(g)
NH3(aq) ΔH2=-35.1 kJ/mol
③HCl(g)
HCl(aq) ΔH3=-72.3 kJ/mol
④NH3(aq)+HCl(aq)===NH4Cl(aq) ΔH4=-52.3 kJ/mol
则反应NH4Cl(s)
NH4Cl(aq)的ΔH5为
A.+16.3 B.-16.3 C.+335.7 D.-335.7
难度: 困难查看答案及解析
-
下列离子方程式属于盐类的水解,且书写正确的是
A.NaHCO3溶液:HCO3-+H2O
CO32-+H3O+
B.NaHS溶液:HS-+H2O
H2S+OH-
C.Na2CO3溶液:CO32-+2H2O
H2CO3+2OH-
D.NH4Cl溶于D2O中:NH4++D2O
NH3·D2O+H+
难度: 中等查看答案及解析
-
在一定条件下,当64 g SO2气体被氧化成SO3气体时,共放出热量98.3 kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是
A.SO2(g)+
O2(g)
SO3(g) ΔH=-98.3 kJ/mol
B.2SO2(g)+O2(g)
SO3(l) ΔH=-196.6 kJ/mol
C.SO2(g)+
O2(g)
SO3(g) ΔH=-122.9 kJ/mol
D.2SO2(g)+O2(g)
SO3(g) ΔH=+196.6 kJ/mol
难度: 中等查看答案及解析
-
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L O2(标准状况),从而可知M的相对原子质量为
A.
B.
C.
D.
难度: 困难查看答案及解析
-
反应mA(s)+nB(g)
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n<p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A.①②④ B.只有②④ C.只有①③ D.①③⑤
难度: 困难查看答案及解析
-
下列关于强弱电解质的叙述错误的是
A.弱电解质在溶液中部分电离,存在电离平衡
B.同一弱电解质的溶液,当温度或浓度不同时,其导电能力也不相同
C.电离常数(K)越小,表示弱电解质电离能力越弱
D.不同浓度的同一弱电解质,其电离常数(K)不同
难度: 中等查看答案及解析
-
铁—镍蓄电池充电放电时发生的反应为:
Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2
关于此蓄电池的下列说法中不正确的是
A.放电时Fe为负极
B.充电时阴极的电极反应式为Ni(OH)2-2e-===NiO2+2H+
C.放电时NiO2的反应为NiO2+2e-+2H2O===Ni(OH)2+2OH-
D.蓄电池的电极必须浸在碱性电解质溶液中
难度: 困难查看答案及解析
-
已知反应:2NO2(g)
N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是

A.反应2NO2(g)
N2O4(g)的正反应为吸热反应
B.上述过程中,A烧瓶内正、逆反应速率均加快
C.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
D.上述过程中,A、B烧瓶内气体密度均保持不变
难度: 困难查看答案及解析
-
密闭容器中进行下列反应:M(g)+N(g)
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是

A. 正反应吸热,L为气体 B.正反应吸热,L为固体或纯液体
C.正反应放热,L为气体 D.正反应放热,L为固体或纯液体
难度: 困难查看答案及解析
-
在恒容密闭容器中A(g)+3B(g)
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
A.容器中混合气体的平均相对分子质量增大
B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.正反应速率和逆反应速率都变小,C的百分含量增加
D.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据
难度: 中等查看答案及解析
-
在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
水的电离过程为H2O
H++OH-,不同温度下其平衡常数为KW(25℃)=1.0×10-14,K(35℃)=2.1×10-14。下列叙述正确的是
A.向水中加入NaHCO3溶液会抑制水的电离
B.35℃时纯水中c(H+)>c(OH-)
C.向水中加入NaHSO4溶液会抑制水的电离
D.c(H+)随着温度的升高而降低
难度: 中等查看答案及解析
-
pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱溶液与强酸溶液的体积比是
A.11∶1 B.9∶1 C.1∶11 D.1∶9
难度: 困难查看答案及解析
-
常温下,下列有关叙述正确的是
A.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L
B.Na2CO3溶液中,2c(Na+)=c(C
)+c(HC
)+c(H2CO3)
C.pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(N
)大小顺序为:①>②>③
D.10 mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,则所得溶液体积V(总)=20 mL
难度: 困难查看答案及解析
-
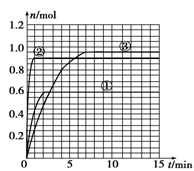
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液,则下列说法中,正确的是
A.25℃时,0.1 mol/L HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
难度: 中等查看答案及解析
-
可逆反应mA(g)+nB(g)
pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示。

①a1=a2②a1<a2③b1=b2④b1<b2⑤t1=t2
⑥t1>t2⑦两图中阴影部分面积相等⑧图乙中阴影部分面积更大以上所列正确的为( )
A.②④⑥⑦ B.②④⑤⑧
C.②③⑤⑦ D.②③⑥⑧
难度: 困难查看答案及解析
-
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+ H2O
H2SO3 + OH- ①
HSO3-
H+ + SO32- ②
向0.05mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B.加入少量NaOH溶液,
、
的值均增大
C.加入少量Na2SO3固体,则
D.加入氨水至中性,则2c(Na+) = c(S
)>c(H+) = c(OH-)
难度: 困难查看答案及解析