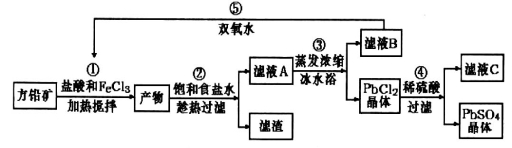
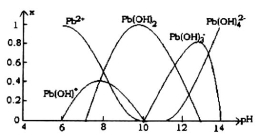
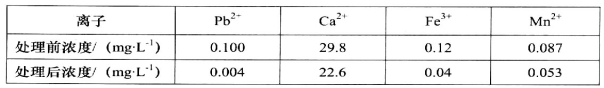
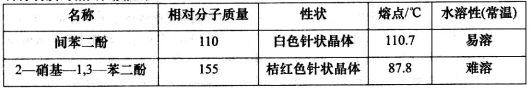
-
民以食为天,食品安全越来越受到大家的关注。下列有关说法正确的是
A.二氧化硫有毒,严禁将其添加到任何食品和饮料中
B.饮食“镉大米”会影响骨骼和肾脏,镉元素属于重金属元素
C.使用增塑剂——邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶
D.面粉生产中禁止添加的过氧化钙(CaO2)中阴阳离子的个数比为1:2
难度: 简单查看答案及解析
-
下列各组离子,在指定的条件下一定能大量共存的是
A.NH4Fe(SO4)2的溶液中: H+、Mg2+、Br-、NO3-
B.含有大量HCO3-的溶液:NH4+、Ca2+、AlO2-、I-
C.浓度为3%的H2O2溶液:H+、Fe2+、C1-、SO42-
D.c(S2-)=0.1mo1·L-1的溶液中:Na+、NH4+、ClO-、SO42-
难度: 中等查看答案及解析
-
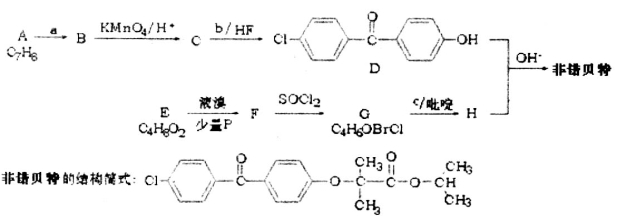
2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:

下列说法不正确的是
A.青蒿素的分子式是C15H22O5,属于烃的衍生物
B.青蒿素难溶于水,而易溶于有机溶剂
C.反应②为取代反应,有H2O生成
D.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基
难度: 中等查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
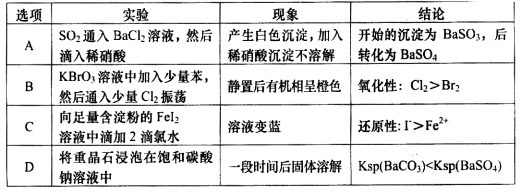
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W在周期表中的相对位置如下图所示,已知它们的最外层电子数之和为21,下列说法一定正确的是

A.X、Y、Z、W中至少有一种是金属元素
B.元素的最高化合价:W>Z>Y
C.简单离子半径由大到小的顺序:W>Z>Y>X
D.一定条件下,W的单质可以置换出Z的单质
难度: 中等查看答案及解析
-
标况下将CO2气体缓缓地通入到含2 mol KOH、1 mol Ba(OH)2和2 mol KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述正确的是
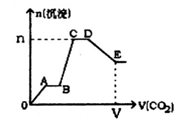
A.A~B段和C~D段发生的反应相同
B.B~C段反应的离子方程式是A1O2-+2H2O+CO2=Al(OH)3↓+HCO3-
C.V=134.4 L,n=3mol
D.D点所得溶液中离子浓度的关系为:c(K+)>c(CO32-)>c(OH﹣)>c(HCO3-)>c(H+)
难度: 困难查看答案及解析