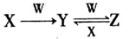-
“玉兔”号月球车用Pu作为热源材料,下列关于Pu的说法正确的是
A.Pu与U互为同位素 B.Pu与Pu互为同素异形体
C.Pu与U具有完全相同的化学性质 D.Pu与Pu具有相同的最外层电子
难度: 中等查看答案及解析
-
决定化学反应速率的主要因素是
A.参加反应的物质本身的性质 B.催化剂
C.温度 D.反应物的浓度或压强
难度: 简单查看答案及解析
-
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为
A.H2XO3 B.HXO3 C.H3XO4 D.H2XO4
难度: 中等查看答案及解析
-
下列说法正确的是
A.离子键是指阴阳离子间的静电引力
B.离子化合物是指只含有离子键的化合物
C.升高温度只能使吸热反应的速率增大,不能使放热反应的速率增大
D.粉碎固体反应物可以增大反应速率
难度: 中等查看答案及解析
-
元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A.左下方区域的金属元素 B.金属元素和非金属元素分界线附近的元素
C.右上方区域的非金属元素 D.稀有气体元素
难度: 简单查看答案及解析
-
下列反应属于吸热反应的是
A.稀硫酸与氢氧化钠溶液反应 B.碳和二氧化碳生成一氧化碳的反应
C.锌与稀硫酸的反应 D.生石灰变成熟石灰的反应
难度: 简单查看答案及解析
-
下列各组物质所含化学键类型完全相同的是
A.HNO3和NH4NO3 B.NaOH和KCl C.NaN3和CaO2 D.AlCl3和MgCl2
难度: 简单查看答案及解析
-
下列各种规律描述正确的是
A.第ⅠA 族元素单质的熔点随着原子序数递增而升高
B.卤族元素单质的熔点随着原子序数递增而升高
C.第ⅤA族元素的气态氢化物沸点随着原子序数递增而升高
D.第三周期元素形成的简单离子半径随着原子序数递增而增大
难度: 简单查看答案及解析
-
下列各组的电极材料和电解液,不能组成原电池的是
A.铜片、铜片、稀硫酸 B.铜片、石墨棒、硝酸银溶液
C.锌片、铜片、稀硫酸 D.铜片、银片、FeCl3溶液
难度: 困难查看答案及解析
-
下列关于元素周期表的叙述中正确的是
A.元素周期表共有18个族 B.含有元素种类最多的族是第ⅠA 族
C.含有元素种类最多的周期是第六周期 D.第五周期有14种金属元素
难度: 简单查看答案及解析
-
已知aAn+、bB(n+1)+、cCn﹣、dD(n+1)﹣均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.原子半径:A>B>C>D B.原子序数:b>a>c>d
C.离子半径:D>C>B>A D.金属性:B>A,非金属性:D>C
难度: 简单查看答案及解析
-
X和Y是短周期元素,二者能形成化合物X2Y3,若Y的原子序数为n,则X的原子序数不可能是
A.n﹣8 B.n﹣3 C.n﹣1 D.n+5
难度: 简单查看答案及解析
-
元素R有如下反应:RO3-+5R-+6H+=3R2+3H2O,下列说法正确的是
A.元素R位于周期表中第ⅤA族 B.RO3-中的R只能被还原
C.R2在常温常压下一定是气体 D.反应每消耗1 mol RO3-,转移电子的物质的量为5 mol
难度: 简单查看答案及解析
-
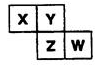
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大。其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如图所示,下列说法正确的是
A.E元素位于周期表中的第三周期、ⅥA族
B.B的简单阴离子比D的简单阴离子还原性强
C.B与C形成的化合物中一定含有共价键
D.A、B两元素形成的常见化合物的分子中均含有极性键
难度: 简单查看答案及解析
-
已知七种短周期元素a~g的有关信息如下表所示:
元素编号
a
b
c
d
e
f
g
原子半径/nm
0.037
0.074
0.082
0.102
0.143
0.152
0.186
最高化合价或最低化合价
+1
-2
+3
-2
+3
+1
+1
下列推断不正确的是
A.氢化物稳定性的强弱:b>d B.金属性的强弱:f<g
C.元素e的氧化物只能与酸反应 D.最高价氧化物对应的水化物的碱性:e<g
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L,W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、M2Z2、W2Z2均为共价化合物
C.由X元素形成的单质不一定能导电
D.由Y、Z、M三种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析
-
A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A、B和稀硫酸组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为
A.A>B>C B.A>C>B C.B>A>C D.B>C>A
难度: 中等查看答案及解析
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 中等查看答案及解析
-
下列关于物质性质变化的比较,不正确的是
A.酸性强弱:HIO4>HBrO4>HClO4 B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH D.金属性强弱: Na>Mg>Al
难度: 中等查看答案及解析
-
在一个密闭容器中,盛有A2和B2它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应只生成AB3,10min后测得A2的浓度是0.8 mol·L-1,则在这10min内AB3的平均反应速率是
A.0.1 mol·L-1·min-1 B.0.3 mol·L-1·min-1
C.0.2 mol·L-1·min-1 D.0.6 mol·L-1·min-1
难度: 中等查看答案及解析