-
下列说法正确的是
A.过氧化钠、烧碱、纯碱分别属于碱性氧化物、碱、盐
B.Na、Al、Cu可以分别用热还原法、热分解法和电解冶炼法得到
C.天然气、沼气和液化石油气分别属于化石能源、不可再生能源和二次能源
D.氯化银、冰醋酸、酒精、水银分别属于强电解质、弱电解质、非电解质、既不是电解质也不是非电解质
难度: 中等查看答案及解析
-
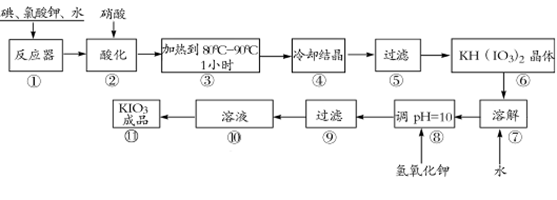
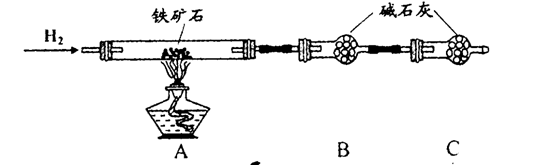
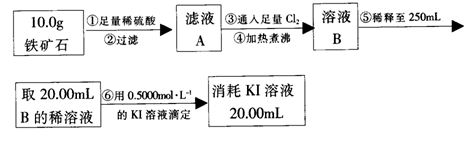
由草木灰提取钾盐并检验含有的钾元素,下列实验操作错误的是
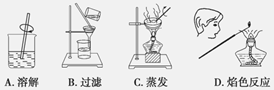
难度: 中等查看答案及解析
-
为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
物质
试剂
分离方法
①
硝酸钾(氯化钠)
蒸馏水
降温结晶
②
二氧化碳(氯化氢)
饱和碳酸钠溶液
洗气
③
乙醇(水)
金属钠
蒸馏
④
NaCl溶液(Na2S)
AgCl
过滤
A.①③ B.①④ C.只有② D.③④
难度: 中等查看答案及解析
-
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X。则
表示的是
A.VL该气体的质量(以g为单位)
B.1L该气体的质量(以g为单位)
C.1mol该气体的体积(以L为单位)
D.1L该气体中所含的分子数
难度: 中等查看答案及解析
-
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
A.(y-2x)/a mol·L-1 B.(y-x)/a mol·L-1
C.(2y-2x)/a mol·L-1 D.(2y-4x)/a mol·L-1
难度: 中等查看答案及解析
-
下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O=2Al(OH)4-
难度: 中等查看答案及解析
-
下列各项内容中,排列顺序正确的是
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3 ②物质的熔点Li>Na>K
③微粒半径:K+>S2->F- ④单质的密度Na<K<Rb ⑤氢化物的沸点:H2Se>H2S>H2O
A.①③ B.②④ C.①② D.③⑤
难度: 中等查看答案及解析
-
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。下列叙述错误的是
A.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3∶2
D.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72-
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:
ClO-+CO2+H2O=HClO+HCO3-
B.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
C.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
D.FeCl2溶液中滴加NaClO溶液生成红褐色沉淀:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+
难度: 中等查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A.②③④ B.①③④ C.①②③④ D.②③④⑤
难度: 中等查看答案及解析
-
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.X2-的还原性一定大于Y-
B.由mXa+与nYb-得m+a=n-b
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性一定是X大于Y
难度: 中等查看答案及解析
-
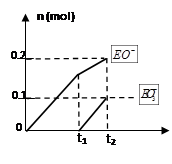
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是
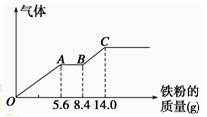
A.原混合酸中NO3-物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol·L-1
难度: 中等查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是
A.原子半径:Z>W>R
B.对应的氢化物的热稳定性:R>W
C.W与X、W与Z形成的化合物的化学键类型完全相同
D.Y的最高价氧化物对应的水化物是弱酸
难度: 困难查看答案及解析
-
铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体,将其加热有铜的氧化物生成,其质量随温度变化的曲线如图1所示。
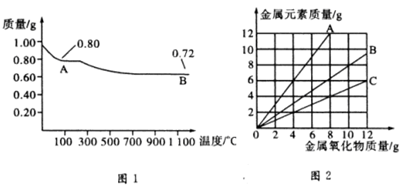
另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。则下列分析正确的是
A.图1中产物A、B的化学式分别为Cu2O和CuO
B.图1整个过程中共生成0.26 g H2O
C.图2三条曲线中,表示CuO和其中所含Cu元素质量的关系曲线是曲线A
D.图2中绘制错误的曲线共2条
难度: 中等查看答案及解析