-
下列物质仅能在水溶液中导电的是
A.HCl B.NaHSO3 C.NaOH D.CH3CH2OH
难度: 简单查看答案及解析
-
下列关于化学反应的描述中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq) +HCI(aq) =NaCI(aq)+H2O(1) △H= 一57.3 kJ·mol-1,
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C. CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为
2CO (g)+ O2(g)=2CO2(g) △H=一283.0 kJ·mol-1
D.已知2C(s) +2O2(g)=2CO2(g) △H=a, 2C(s) +O2(g)=2CO (g) △H=b,则b>a
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法不正确是
A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸
B.高纯度的硅单质广泛用于制作光导纤维
C.二氧化氯具有氧化性,可用于白来水的杀菌消毒
D.在海轮外壳上镶人锌块,可减缓船体的腐蚀速率
难度: 中等查看答案及解析
-
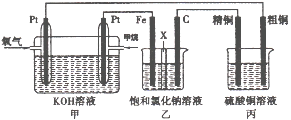
下列实验过程中,始终无明显现象的是
A.NO2通人FeSO4溶液中 B.CO2通人CaCl2溶液中
C.NH3通人AlCl3溶液中 D.SO2通人已酸化的Ba( NO3 )2溶液中
难度: 中等查看答案及解析
-
下列各组气体在常温下能共存且能用向上排空气法收集的是
A. NO和O2 B. H2和CO C. HCl和NH3 D. SO2和CO2
难度: 中等查看答案及解析
-
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法错误的是
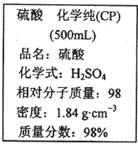
A.该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管
B.取10 mL该硫酸于烧杯中,再加等体积的水,可配得49%的硫酸
C.配制200mL4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol·L-1
难度: 中等查看答案及解析
-
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
A. CaO2具有氧化性,对面粉可能具有增白作用
B. CaO2中阴阳离子的个数比为1:1
C. CaO2和水反应时,每产生1 mol O2转移电子4 mol
D. CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.1mol Na2O2晶体中共含有4NA个离子
B.0.1 mol A1C13完全水解转化为氢氧化铝胶体,生成0. 1 NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.电解精炼铜时每转移NA个电子,阳极溶解32g铜
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是
A.足量的硫酸铝溶液与纯碱溶液反应: 2A13++3CO32-+3H20 =2A1(OH)3↓+3CO2↑
B. NaHS溶液的水解方程式: HS-+H2O
H3O++S2-
C. Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O
D.向亚硫酸氢铵溶液中加入足量的NaOH溶液: NH4++OH-=NH3·H2O
难度: 困难查看答案及解析
-
下列关于离子检验的说法中,正确的是
A.向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有C1-
B.向某溶液中加入稀盐酸,产生无色气体,则该溶液中一定含有CO32-
C.向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42-
D.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+
难度: 中等查看答案及解析
-
下列操作或仪器的选用正确的是
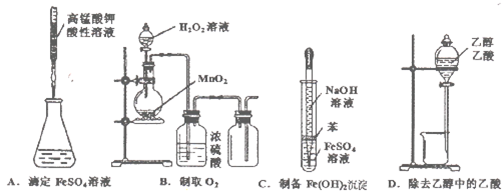
难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系表述正确的是
A. 0.1 mol/LNa2CO3溶液中:c(Na+)=(HCO3-)+c(H2CO3)+2c(CO32-)
B.常温下pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
C.将0.2mol/LNaA溶液和0.1 mol·L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D. pH=l2的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
难度: 困难查看答案及解析
-
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢
氧燃料电池技术相结合的可充电电池。如图为RFC工作原理示意图。下列有关说法正确的是
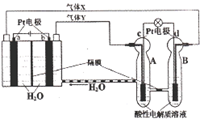
A.当有0.1 mol电子转移时,a电极产生2.24LH2
B.b电极上发生的电极反应是:4H2O +4e-=2H2↑+4OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
难度: 困难查看答案及解析
-
W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加人XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加人量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
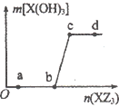
A.d点对应的溶液中:K+、NH4+、CO32-、I-
B.c点对应的溶液中:Ag+、Ca2+、NO3-、Na+
C.b点对应的溶液中:Na+、S2-、SO42-、Cl-
D.a点对应的溶液中:Na+、K+、S042-、HCO3-
难度: 困难查看答案及解析
-
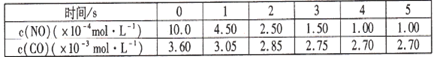
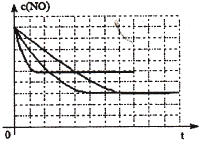
可逆反应2A(g)+B(g)
2C(g),根据下表中的数据判断下列图像错误的是
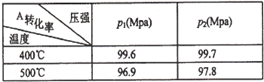
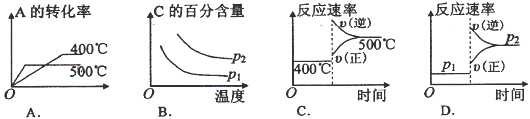
难度: 困难查看答案及解析
-
将a molNa2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250OC,让其充分反应。当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,a/b值可能为
A.0.5 B.0.25 C. 0.85 D.1.0
难度: 中等查看答案及解析