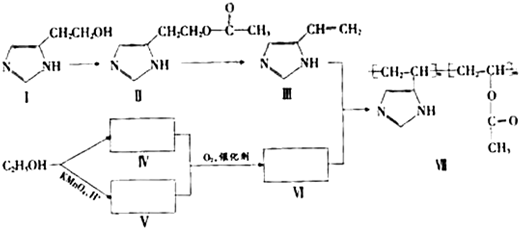
-
下列说法与“节能减排”不相符的是( )
A.为推广氢能的使用,工业上可采用电解水法制取大量氢气
B.将石油裂化、裂解,综合利用石油资源
C.有节制地开采煤、石油、天然气等矿物资源
D.倡导“绿色化学”理念,逐步实现化工企业零排放难度: 中等查看答案及解析
-
下列关于氯的说法正确的是( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.1735Cl、1737Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数)难度: 中等查看答案及解析
-
下列关于有机物的说法错误的是( )
A.CCl4可由CH4制得,可萃取碘水中的碘
B.石油和天然气的主要成分都是碳氢化合物
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应难度: 中等查看答案及解析
-
下列叙述中不正确的是( )
A.在0.1mol/LCH3COOH溶液中,c(H+)=c(CH3COO-)+c(OH-)
B.常温下将10mL0.02mol/LNaOH溶液与10mL0.02mol/LH2SO4溶液充分混合,若混合后溶液的体积为20mL,则混合后溶液的pH=2
C.在0.1mol/LNH4Cl溶液中,c(H+)=c+c(OH-)
D.在0.1mol/LNa2CO3溶液中,2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-)难度: 中等查看答案及解析
-
短周期元素甲、乙、丙,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素的最高正价和最低负价的代数和等于4.则下列判断不正确的是( )
A.丙元素的族序数比甲元素的大
B.原子半径从大到小的顺序:甲>乙
C.甲的最高价氧化物的水化物的酸性比硝酸的强
D.乙、丙元素的气态氢化物的热稳定性:乙>丙难度: 中等查看答案及解析
-
在溶液中能大量共存的一组离子或分子是( )
A.NH4+、H+、NO3-、HCO3-
B.K+、Al3+、SO42-、NH3•H2O
C.Na+、K+、SO32-、Cl2
D.Na+、CH3COO-、CO32-、OH-难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的杀菌净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁难度: 中等查看答案及解析
-
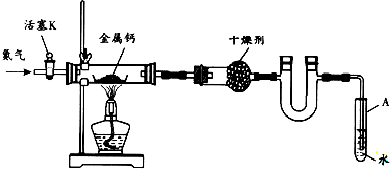
下列有关实验操作的叙述正确的是( )
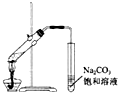
A.实验室常用右上图所示的装置制取少量的乙酸乙酯
B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液
C.用量筒取5.00mL1.00mol•L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol•L-1盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的上口倒出难度: 中等查看答案及解析