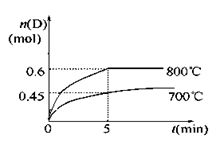
-
化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了节约资源,为了防止白色污染
难度: 简单查看答案及解析
-
节能减排成为社会发展过程中不可回避的问题。下列说法正确的是
①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量。
②乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点之一。
③乙醇属于可再生资源,使用乙醇汽油可以缓解目前石油紧缺的矛盾。
④太阳能、风能、水能、生物质能、地热能和海洋能等都属于可再生能源。
⑤乙醇属于一级能源
A.①②⑤ B.①②③ C.③④ D.①②③④
难度: 中等查看答案及解析
-
在一定条件下,对于A2(g)+3B2(g)
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=30 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
难度: 中等查看答案及解析
-
下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大
C.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
难度: 中等查看答案及解析
-
把0.05 mol NaOH固体分别加入下列100 mL溶液中,溶液的导电性基本不变的是
A.自来水 B.0.5 mol/L盐酸
C.0.5 mol/L醋酸 D.0.5 mol/L mol·Lˉ1氨水
难度: 中等查看答案及解析
-
以石墨做电极,电解1 mol/L下列物质的水溶液,下列表述正确的是
A.若为盐酸,pH减小 B.若为氢氧化钠溶液,pH减小
C.若为硫酸钠溶液,pH不变 D.若为氯化钠溶液,pH不变
难度: 中等查看答案及解析
-
下列事实可用勒夏特列原理解释的是
A.使用催化剂有利于加快合成氨反应的反应速率
B.硫酸工业中,将黄铁矿粉碎后加入沸腾炉中
C.500℃左右比在室温时更有利于提高合成氨的转化率
D.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.已知C(石墨, s)=C(金刚石, s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1 ;C(s)+1/2O2(g)=CO(g) ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH= -483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol
难度: 中等查看答案及解析
-
关于pH相同的醋酸和盐酸,下列叙述正确的是
A.取等体积的醋酸和盐酸,分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m<n
B.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸
C.取等体积的两种酸,分别用完全一样的NaOH溶液进行中和,醋酸消耗NaOH的物质的量比盐酸消耗的多
D.两种酸中c (CH3COO-) > c (Cl-)
难度: 中等查看答案及解析
-
如图所示装置中都盛有0.1 mol/L的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的正确顺序是
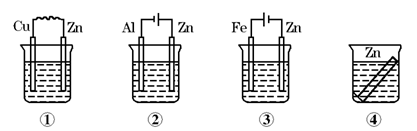
A.③①④② B.①②④③ C.①②③④ D.②①④③
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.无色溶液中:K+、Fe3+、SO42-、SCN-
C.c (H+)/c (OH-) = 1012 的溶液中:NH4+、Al3+、NO3-、Cl-
D.由水电离的c (H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
难度: 中等查看答案及解析
-
在温度相同,压强分别为p1、p2条件下,A(g)+2B(g)
nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.下列结论正确的是
A.p1 > p2 n < 3 B.p1 < p2 n > 3
C.p1 < p2 n = 3 D.p1 > p2 n > 3
难度: 中等查看答案及解析
-
下列有关电解质溶液的叙述正确的是
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
难度: 中等查看答案及解析
-
X、Y、Z、M、N代表五种金属,有以下化学反应:
①水溶液中:X+Y2+=X2++Y;
②Z+2H2O(冷)=Z(OH)2+H2↑;
③M、N为电极与N盐溶液组成原电池,负极反应为:M-2e-=M2+;
④Y可以溶于稀H2SO4中,M不能被H2SO4氧化,则这五种金属的活动性由弱到强的顺序是
A.M<N<Y<X<Z B.N<M<Y<X<Z
C.N<M<X<Y<Z D.X<Z<N<M<Y
难度: 中等查看答案及解析
-
下列叙述中,正确的是
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电伴随化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.①②③④ B.③④ C.③④⑤ D.④
难度: 中等查看答案及解析
-
一定条件下,可逆反应C(s)+CO2(g)
2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.②④ D.①③④
难度: 中等查看答案及解析
-
有关右图装置中的叙述正确的是
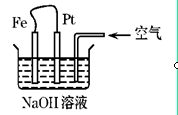
A.这是电解NaOH溶液的装置
B.这是一个原电池装置
C.Pt为负极,其电极反应为:O2+2H2O+4e-= 4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH- = 2Fe(OH)2
难度: 中等查看答案及解析
-
在1L密闭容器中,把l mol A和1 mol B混合发生如下反应:
3A(g) + B(g)
XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
A.x的值为2 B.A的转化率为40%
C.B的平衡浓度为0.8 mol/L D.达到平衡时D的体积分数为20%
难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c (Cl-) > c (NH4+) > c (H+)> c (OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
难度: 中等查看答案及解析
-
镁—H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是
A.电池总反应为Mg+H2O2 = Mg(OH)2
B.正极发生的电极反应为H2O2+2H++2e- = 2H2O
C.工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
难度: 中等查看答案及解析