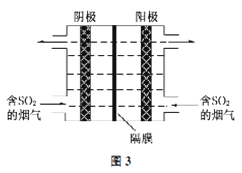
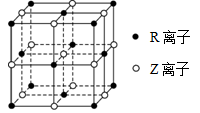
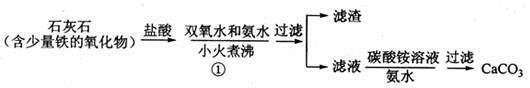
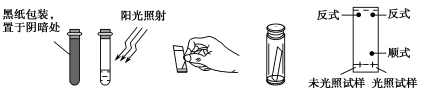
-
下列与生产、生活相关的化学知识描述正确的是
A. 焚烧废旧塑料以防止“白色污染”
B. 明矾可用于净水,也可用于淡化海水
C. 水瓶胆内部的水垢可用饱和食盐水清洗
D. 氢氧燃料电池推广使用可实现碳零排放
难度: 简单查看答案及解析
-
下列有关卤族元素及其化合物的表示正确的是
A. 氟离子的结构示意图:

B. 次氯酸分子的电子式:
C. 2,4,6-三溴苯的结构简式:
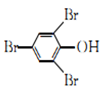
D. 质子数为53,中子数为78的碘原子:
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 碱石灰具有吸水性,可用于干燥氯气
B. 甲醛能使蛋白质变性,可以用于食品防腐剂
C. 炭具有强还原性,常用于冶炼钠、钾等金属
D. 碳酸氢钠溶液具有弱碱性,可用于制胃酸中和剂
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、U、W原子序数依次增大,X位于IA族,Y原子最外层电子数是其内层电子数的2倍,Z的简单气态氢化物的稳定性最强,U是地壳中含量最多的金属元素,W与Z属于同一主族,下列叙述正确的是
A. 由X与W形成的化合物是离子化合物
B. Z元素的最低化合价位-1,最高化合价为+7
C. Y的最高价氧化物对应水化物的酸性比U的强
D. Z的简单离子半径小于U的简单阳离子半径
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 用FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
B. 向氨水中通入过量SO2:SO2+2NH3·H2O=2NH4++SO32-+H2O
C. 用MnO2与浓盐酸反应制Cl2:MnO2+4HCl
Mn2++2Cl-+Cl2↑+2H2O
D. 在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-=2FeO43-+3Cl-+5H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A. 在海轮船壳上镶入锌块保护海轮,利用的是牺牲阳极的阴极保护法
B. KNO3溶液和CH3OONH4溶液均显中性.两溶液中水的电离程度相等
C. 若1 molNa2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023
D. 用pH 均为2 的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
难度: 中等查看答案及解析
-
右图为1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的能量变化的示意图,已知E1=xKJ/mol、E2=yKJ/mol,下列有关说法正确的是

A. 若在反应体系中加人催化剂,E1不变
B. 若在反应体系中加人催化剂, ΔH减小
C. 该反应的活化能等于ykJ/mol
D. 1 mol SO2Cl2 (g)和1mol SCl2(g)反应生成SOCl2(g)的ΔH=(x-y)kJ/mol
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质均能实现的是
A.
B.

C.

D.

难度: 简单查看答案及解析
-
下列图示与对应叙述相符的是

A. 图甲表示相同温度下,相同体积、pH 均为1的盐酸与醋酸溶液分别为加水稀释时溶液pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图乙表示CH3COOH溶液中逐步加人CH3COONa固体后.溶液pH的变化
C. 图丙表示某可逆反应正、逆反应速率随温度变化,则该反应的正反应是吸热反应
D. 图丁表示等量NO2在容积相同的恒容密闭容器中.不同温度下分别发生反应:2NO2(g)
N2O4(g)相同时间后测得NO2体积分数的曲线.则该反应的正反应ΔH<O
难度: 困难查看答案及解析
-
某有机物A的结构简式如图所示,下列有关叙述中正确的是
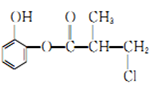
A. 有机物A与浓硫酸混合加热,可以发生消去反应
B. 1 molA 与足量的H2发生加成反应,最多可以消耗4mol H2
C. 1 molA 与足量的NaOH 溶液充分反应,最多可以消耗4 mol NaOH
D. 有机物A 的同分异构体中能在稀硫酸存在下水解生成二苯酚的有6 种
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1mol/L NaHSO4溶液中:K+、AlO2-、Cl-、CH3COO-
B. 0.1mol/L NaHCO3溶液中:Al3+、Ca2+、SO42-、NO3-
C. 0.1mol/L FeCl3溶液中: NH4+、NO3-、Na+、SO42-
D. 0.1mol/L H2O2溶液中:Na+、K+、SO32-、Cl-
难度: 中等查看答案及解析
-
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
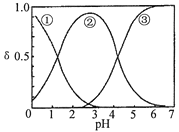
A.曲线①代表的粒子是HC2O4-
B.0.1 mol•L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4)
C.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
D.一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
难度: 困难查看答案及解析
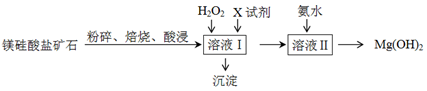
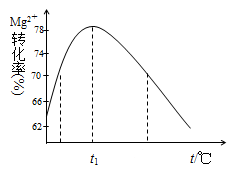
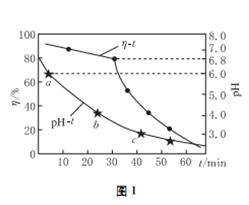
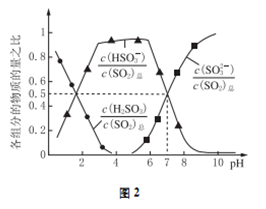
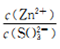 =________
=________